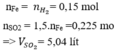Hòa tan hết a gam Fe trong dung dịch H2SO4 loãng thì sinh ra 3,36 lít khí (đktc). Nếu cho 1,25a gam Fe này vào lượng dư dung dịch H2SO4 đặc nóng thì thể tích khí sunfurơ sinh ra là

Những câu hỏi liên quan
Hòa tan m gam Fe trong dung dịch
H
2
S
O
4
loãng thì sinh ra 3,36 lít khí (đktc). Nếu cho m gam sắt này vào dung dịch
H
2
S
O
4
đặc, nóng thì thể tích khí (đktc) sinh ra bằng A. 2,24 lít B. 5,04 lít C. 3,36 lít D. 10,08 lít
Đọc tiếp
Hòa tan m gam Fe trong dung dịch H 2 S O 4 loãng thì sinh ra 3,36 lít khí (đktc). Nếu cho m gam sắt này vào dung dịch H 2 S O 4 đặc, nóng thì thể tích khí (đktc) sinh ra bằng
A. 2,24 lít
B. 5,04 lít
C. 3,36 lít
D. 10,08 lít
Hòa tan m gam Fe trong dung dịch H2SO4 loãng thì sinh ra 3,36 lít khí (đktc). Nếu cho m gam Fe tác dụng với H2SO4 đặc, nóng, dư thì thu được V lít khí SO2 (đktc). Giá trị của V là A. 10,08. B. 5,04. C. 3,36. C. 3,36.
Đọc tiếp
Hòa tan m gam Fe trong dung dịch H2SO4 loãng thì sinh ra 3,36 lít khí (đktc). Nếu cho m gam Fe tác dụng với H2SO4 đặc, nóng, dư thì thu được V lít khí SO2 (đktc). Giá trị của V là
A. 10,08.
B. 5,04.
C. 3,36.
C. 3,36.
Đáp án B
Xét giai đoạn m gam Fe tác dụng với dung dịch H2SO4 loãng:
Sơ đồ phản ứng :
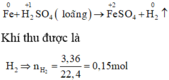
Các quá trình nhường, nhận electron :
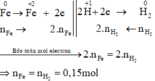
Xét giai đoạn m gam Fe tác dụng với H2SO4 đặc, nóng , dư:
Sơ đồ phản ứng:
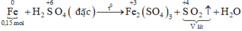
Các quá trình nhường, nhận electron:
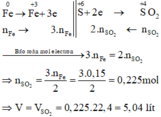
Đúng 0
Bình luận (0)
Hòa tan hết 15,2 gam hỗn hợp hai kim loại Fe và Cu trong dung dịch H2SO4 đặc, nóng, dư, thu được 6,72 lít khí SO2 (sản phẩm khử duy nhất, ở đktc). Mặt khác cho 1,52 gam hỗn hợp vào dung dịch H2SO4 loãng dư thì thể tích khí thoát ra ở đktc là A. 0,672 lít. B. 2,24 lít. C. 0,224 lít. D. 0,448 lít.
Đọc tiếp
Hòa tan hết 15,2 gam hỗn hợp hai kim loại Fe và Cu trong dung dịch H2SO4 đặc, nóng, dư, thu được 6,72 lít khí SO2 (sản phẩm khử duy nhất, ở đktc). Mặt khác cho 1,52 gam hỗn hợp vào dung dịch H2SO4 loãng dư thì thể tích khí thoát ra ở đktc là
A. 0,672 lít.
B. 2,24 lít.
C. 0,224 lít.
D. 0,448 lít.
Đáp án C
Trong 15,2 gam hỗn hợp kim loại
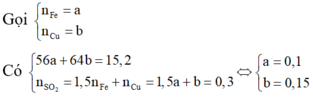
Do đó trong 1,52 gam hỗn hợp kim loại có 0,01 mol Fe.
Khi hòa tan 1,52 gam hỗn hợp kim loại vào dung dịch H2SO4 loãng dư thì nH = nF = 0,01
⇒ V H 2 = 0 , 224 ( lít )
Đúng 0
Bình luận (0)
Dẫn khí CO dư đi qua ống sứ đựng bột oxit sắt nung nóng. Dẫn hết khí sinh ra vào dung dịch Ca(OH)2, thu được 8 gam kết tủa. Hòa tan hết lượng Fe thu được ở trên bằng dung dịch H2SO4 loãng, dư thì thoát ra 1,344 lít H2 (đktc). Công thức oxit sắt đem dùng là
$CO + O_{oxit} \to CO_2$
$CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O$
$n_{O(oxit)} = n_{CaCO_3} = \dfrac{8}{100} = 0,08(mol)$
$Fe + H_2SO_4 \to FeSO_4 + H_2$
$n_{Fe} = n_{H_2} = \dfrac{1,344}{22,4} = 0,06(mol)$
Ta có :
$n_{Fe} : n_O = 0,06 : 0,08 = 3 : 4$
Vậy oxit là $Fe_3O_4$
Đúng 3
Bình luận (0)
Công thức oxit sắt có dạng: \(Fe_xO_y\)
\(Fe_xO_y+yCO\rightarrow xFe+yCO_2\uparrow\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
\(\Rightarrow n_{Fe}=n_{H_2}=\dfrac{1,344}{22,4}=0,06\left(mol\right)\)
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3\downarrow+H_2O\)
\(\Rightarrow n_{CO}=n_{CO_2}=n_{CaCO_3}=0,08\left(mol\right)\)
\(\Rightarrow n_{O\left(Fe_xO_y\right)}=n_{O\left(CO_2\right)}-n_{O\left(CO\right)}=2n_{CO_2}-n_{CO}=0,08\left(mol\right)\)
\(\Rightarrow n_{Fe}:n_O=0,06:0,08=3:4\)
\(\Rightarrow Fe_3O_4\)
Đúng 1
Bình luận (0)
\(Co+\left\{{}\begin{matrix}Fe:amol\\O:bmol\end{matrix}\right.\)\(\rightarrow\left[{}\begin{matrix}Fe\rightarrow H_2SO_4\\Co_2\rightarrow Ca\left(OH\right)_2\rightarrow caCo_3\end{matrix}\right.\)
\(\cdot m\downarrow=m_{CaCo_3}=8\Rightarrow n_{CaCo_3}=n_{Co_2}=\dfrac{8}{100}=0,08\)
\(\Rightarrow n_O=n_{CO}=n_{CO_2}=0,08\)
\(\cdot Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
0,06 0,06
\(n_{H_2}=\dfrac{1,344}{22,4}=0,06\Rightarrow n_{Fe}=n_{H_2}=0,06\)
\(\Rightarrow\dfrac{n_{Fe}}{n_O}=\dfrac{0,06}{0,08}=\dfrac{3}{4}\Rightarrow Fe_3O_4\)
Đúng 0
Bình luận (0)
Hòa tan a gam hỗn hợp X ( gồm nhôm và đồng)vào dung dịch h2so4 loãng dư sau phản ứng thu được 2,688 lít khí .Nếu đem hòa tan a gam hỗn hợp X vào dung dịch h2so4 đặc nóng thì sau phản ứng thu được 4.48 lít khí .Tính a ( thể tích các khí ở đktc)
X là kim loại thuộc nhóm IIA. Cho 8 gam hỗn hợp gồm kim loại X và Fe tác dụng với lượng dư dung dịch HCl, sinh ra 4,48 lít khí
H
2
(ở đktc). Mặt khác, khi cho 4,8 gam X tác dụng với lượng dư dung dịch
H
2
S
O
4
loãng, thì thể tích khí hiđro sinh ra chưa đến 5,6 lít (ở đktc). Kimloại X là A. Ba B. Ca C. Sr D. Mg
Đọc tiếp
X là kim loại thuộc nhóm IIA. Cho 8 gam hỗn hợp gồm kim loại X và Fe tác dụng với lượng dư dung dịch HCl, sinh ra 4,48 lít khí H 2 (ở đktc). Mặt khác, khi cho 4,8 gam X tác dụng với lượng dư dung dịch H 2 S O 4 loãng, thì thể tích khí hiđro sinh ra chưa đến 5,6 lít (ở đktc). Kimloại X là
A. Ba
B. Ca
C. Sr
D. Mg
Hoà tan hết cùng một lượng Fe trong dung dịch
H
2
S
O
4
loãng (dư) và dung dịch
H
2
S
O
4
đặc, nóng (dư) thì các thế tích khí sinh ra lần lượt là
V
1
,
V
2
(đo ở cùng điều kiện). Liên hệ giữa
V
1
,
...
Đọc tiếp
Hoà tan hết cùng một lượng Fe trong dung dịch H 2 S O 4 loãng (dư) và dung dịch H 2 S O 4 đặc, nóng (dư) thì các thế tích khí sinh ra lần lượt là V 1 , V 2 (đo ở cùng điều kiện). Liên hệ giữa V 1 , V 2 là
A. V 1 = V 2
B. V 1 = 2 V 2
C. V 2 = 1 , 5 V 1
D. V 2 = 3 V 1
Hoà tan hoàn toàn x gam hỗn hợp A gồm Cu và Fe trong lượng dư dung dịch H2SO4 98%, đun nóng, thu được 22,4 lít khí SO2 (là sản phẩm khử duy nhất) . Mặt khác nếu cho x gam hỗn hợp A tác dụng với dung dịch H2SO4 loãng, dư thì thấy thoát ra 11,2 lít khí . Các thể tích đo ở điều kiện tiêu chuẩn.a, Tính xb, Tính thể tích dung dịch H2SO4 98% (D1,84g/cm3) đã đem dùng . Biết lượng axit trên được lấy dư 10% so với lượng cần thiếtc, Cho toàn bộ khí SO2 thu được ở trên hấp thụ vào 400 ml dung dịch Ba(OH)2 ...
Đọc tiếp
Hoà tan hoàn toàn x gam hỗn hợp A gồm Cu và Fe trong lượng dư dung dịch H2SO4 98%, đun nóng, thu được 22,4 lít khí SO2 (là sản phẩm khử duy nhất) . Mặt khác nếu cho x gam hỗn hợp A tác dụng với dung dịch H2SO4 loãng, dư thì thấy thoát ra 11,2 lít khí . Các thể tích đo ở điều kiện tiêu chuẩn.
a, Tính x
b, Tính thể tích dung dịch H2SO4 98% (D=1,84g/cm3) đã đem dùng . Biết lượng axit trên được lấy dư 10% so với lượng cần thiết
c, Cho toàn bộ khí SO2 thu được ở trên hấp thụ vào 400 ml dung dịch Ba(OH)2 1,5M . Tính nồng độ mol của các chất trong dung dịch sau phản ứng. Coi thể tích dung dịch không thay đổi.
a, \(Fe+H_2SO_{4\text{loãng}}\rightarrow FeSO_4+H_2\)
\(n_{Fe}=n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
\(Fe+H_2SO_{4\text{đặc}}\rightarrow Fe_2\left(SO_4\right)_3+SO_2+H_2O\)
\(Cu+H_2SO_{4\text{đặc}}\rightarrow CuSO_4+SO_2+H_2O\)
Bảo toàn e:
\(2n_{Cu}+3n_{Fe}=2n_{SO_2}\)
\(\Leftrightarrow n_{Cu}=\dfrac{2n_{SO_2}-3n_{Fe}}{2}=0,25\left(mol\right)\)
\(\Rightarrow x=m_{Cu}+m_{Fe}=0,25.64+0,5.56=44\left(g\right)\)
Đúng 0
Bình luận (1)
a) Đặt \(\left\{{}\begin{matrix}n_{Cu}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\)
Ta có: \(\left\{{}\begin{matrix}n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)=b=n_{Fe}\\n_{SO_2}=\dfrac{22,4}{22,4}=1\left(mol\right)\end{matrix}\right.\)
Bảo toàn electron: \(2a+3b=2\) \(\Rightarrow2a+3\cdot0,5=2\) \(\Rightarrow a=n_{Cu}=0,25\left(mol\right)\)
\(\Rightarrow x=m_{Cu}+m_{Fe}=0,25\cdot64+0,5\cdot56=44\left(g\right)\)
b) Ta có: \(n_{H_2SO_4\left(p/ư\right)}=\dfrac{1}{2}n_{e\left(traođổi\right)}+n_{SO_2}=\dfrac{1}{2}\cdot2+1=2\left(mol\right)\)
\(\Rightarrow\Sigma n_{H_2SO_4\left(đặc\right)}=2\cdot110\%=2,2\left(mol\right)\)
\(\Rightarrow m_{ddH_2SO_4}=\dfrac{2,2\cdot98}{98\%}=220\left(g\right)\) \(\Rightarrow V_{H_2SO_4}=\dfrac{220}{1,84}\approx119,57\left(ml\right)\)
c) Ta có: \(\left\{{}\begin{matrix}n_{SO_2}=1\left(mol\right)\\n_{Ba\left(OH\right)_2}=0,4\cdot1,5=0,6\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) Tạo 2 muối
PTHH: \(2SO_2+Ba\left(OH\right)_2\rightarrow Ba\left(HSO_3\right)_2\)
2x x x (mol)
\(SO_2+Ba\left(OH\right)_2\rightarrow BaSO_3\downarrow+H_2O\)
y y (mol)
Ta lập được hệ phương trình: \(\left\{{}\begin{matrix}x+y=0,6\\2x+y=1\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}x=n_{Ba\left(HSO_3\right)_2}=0,4\left(mol\right)\\y=0,2\end{matrix}\right.\)
\(\Rightarrow C_{M_{Ba\left(HSO_3\right)_2}}=\dfrac{0,4}{0,4}=1\left(M\right)\)
Đúng 1
Bình luận (0)
Bài 5: Hòa tan 0,56 gam sắt vào dung dịch H2SO4 loãng 19,6%, phản ứng vừa đủ
a/ Tính khối lượng muỗi tạo thành và thể tích khí sinh ra ở đktc |
b/ Tính khối lượng dung dịch H2SO4 đã dùng
Cho Fe=56;S=32;0= 16
Ta có: \(n_{Fe}=\dfrac{0,56}{56}=0,01\left(mol\right)\)
\(PTHH:H_2SO_4+Fe--->FeSO_4+H_2\)
a. Theo PT: \(n_{H_2SO_4}=n_{FeSO_4}=n_{H_2}=n_{Fe}=0,01\left(mol\right)\)
\(\Rightarrow m_{FeSO_4}=0,01.152=1,52\left(g\right)\)
\(V_{H_2}=0,01.22,4=0,224\left(lít\right)\)
b. Ta có: \(m_{H_2SO_4}=0,01.98=0,98\left(g\right)\)
Ta lại có: \(C_{\%_{H_2SO_4}}=\dfrac{0,98}{m_{dd_{H_2SO_4}}}.100\%=19,6\%\)
\(\Rightarrow m_{dd_{H_2SO_4}}=5\left(g\right)\)
Đúng 1
Bình luận (0)