một nguyên tử có tổng hợp là 40 trong đó có số hạt mang điện tích nhiều hơn số hạt không mang điện tích là 12.tính số p,số e,số n

Những câu hỏi liên quan
Nguyên tử có tổng số hạt p,n,e bằng 40 hạt trong đó tổng số hạt mang điện tích nhiều hơn hạt không mang điện tích 12 hạt. Tính
Ta có :
\(\begin{cases}p+e+n=40\\\left(p+e\right)-n=12\end{cases}\)
\(\Rightarrow\begin{cases}2p+n=40\left(1\right)\\2p-n=12\left(2\right)\end{cases}\)
Cộng (1) và (2) ta có :
\(\left(2p+n\right)+\left(2p-n\right)=40+12\)
\(\Rightarrow4p=52\)
\(\Rightarrow p=e=13\)
\(\Rightarrow n=14\)
NTk = 13 + 14 = 27
=> Nhôm ( Al )
Đúng 0
Bình luận (1)
Ta có p + e + n =40; (p+e)-n=12
=> n = (40-12):2= 14(hạt)
=> ( p+e)=40-14=26(hạt)
=> p = e = 26:2=13
Ntk=13+14=27
=> Đó là nhôm (Al)
Đúng 0
Bình luận (0)
-vì tổng số hạt trong nguyên tử là 40
=>p+n+e=40.mà p=e
<=>2p+n=40.(1).
-vì số hạt mang điện tích nhiều hơn số hạt không mang điện tích là 12:
=>(p+e)-n=12.mà p=e
<=>2p-n=12.(2).
từ (1)và(2) ta có hệ pt:
2p+n=40
2p-n=12
<=>giải ra được:p=e=13,n=14.
=>NTK=13+14=27=>nhôm(Al).
Đúng 0
Bình luận (0)
Câu 4: Tìm số E, P. N trong các trường hợp sau:a. Nguyên tử nhôm có tổng số hạt là 40, trong hạt nhân số hạt không mang điện nhiều hơn số hạt mang điện là 1. b. Nguyên tử một nguyên tố R có tổng các hạt 21, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 7.c. Hạt nhân nguyên tử một nguyên tố X có tổng các hạt 16, tỉ lệ giữa số hạt mang điện và số hạt không mang điện là 1:1.
Đọc tiếp
Câu 4: Tìm số E, P. N trong các trường hợp sau:
a. Nguyên tử nhôm có tổng số hạt là 40, trong hạt nhân số hạt không mang điện nhiều hơn số hạt mang điện là 1.
b. Nguyên tử một nguyên tố R có tổng các hạt 21, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 7.
c. Hạt nhân nguyên tử một nguyên tố X có tổng các hạt 16, tỉ lệ giữa số hạt mang điện và số hạt không mang điện là 1:1.
a,
Ta có: \(\left\{{}\begin{matrix}p+e+n=40\\p=e\\n-p=1\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}3p=39\\n=p+1\\p=e\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}p=e=13\\n=14\end{matrix}\right.\)
b,
Ta có: \(\left\{{}\begin{matrix}p+e+n=21\\p=e\\p+e-n=7\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}2n=14\\p=e\\p+e+n=21\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}p=e=7\\n=7\end{matrix}\right.\)
c,
Ta có: \(\left\{{}\begin{matrix}p+n=16\\p=e\\\dfrac{p}{n}=\dfrac{1}{1}\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}2p=16\\p=e\\p=n\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}p=e=8\\n=8\end{matrix}\right.\)
Đúng 2
Bình luận (1)
Một nguyên tử X có tổng số hạt p, n, e bằng 40. Trong đó tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12 hạt. Số khối của nguyên tử X là: A. 13 B. 40 C. 14 D. 27
Đọc tiếp
Một nguyên tử X có tổng số hạt p, n, e bằng 40. Trong đó tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12 hạt. Số khối của nguyên tử X là:
A. 13
B. 40
C. 14
D. 27
Đáp án D
Vì trong nguyên tử X, số electron bằng số proton nên tổng số hạt trong nguyên tử X là:
Mặt khác, tổng số hạt mang điện nhiều hơn số hạt không mang điện là 12 nên: (2)
Từ (1) và (2) suy ra: 
Đúng 0
Bình luận (0)
Một nguyên tử X có tổng số hạt p, n, e bằng 40. Trong đó tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12 hạt. Số khối của nguyên tử X là:
A. 13
B. 40
C. 14
D. 27
Vì trong nguyên tử X, số electron bằng số proton nên tổng số hạt trong nguyên tử X là:
![]()
Mặt khác, tổng số hạt mang điện nhiều hơn số hạt không mang điện là 12 nên:
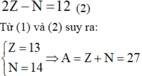
Đáp án D
Đúng 0
Bình luận (0)
một nguyên tử X có tổng số hạt p,n,e bằng 40 . trong đó tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12 hạt. xác định số khối của nguyên tử X
Ta có: \(\left\{{}\begin{matrix}p+e+n=40\\p=e\\p+e-n=12\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}p=e=13\\n=14\end{matrix}\right.\)
\(\Rightarrow A=p+n=13+14=27\left(u\right)\)
Đúng 0
Bình luận (0)
Nguyên tố X có tổng số hạt trong nguyên tử là 40, trong đó số hạt mang điện nhiều hơn hạt không mang điện là 12. Nguyên tố Y có tổng số hạt nguyên tử là 52. Số hạt mang điện nhiều hơn hạt mang điện trong X là 8. xác định Ct hợp chất gồm hai nguyên tố x và y
Do nguyên tử X có tổng số hạt trong nguyên tử là 40
=> 2pX + nX = 40 (1)
Do nguyên tử X có số hạt mang điện nhiều hơn số hạt không mang điện là 12 hạt
=> 2pX - nX = 12 (2)
(1)(2) => \(\left\{{}\begin{matrix}e_X=p_X=13\\n_X=14\end{matrix}\right.\) => X là Al
Nguyên tử X có số hạt mang điện là 13 + 13 = 26 (hạt)
=> Nguyên tử Y có số hạt mang điện là 26 + 8 = 34 (hạt)
=> eY = pY = 17 (hạt)
=> Y là Cl
CTHH hợp chất 2 nguyên tố X, Y có dạng AlxCly
Có: \(Al^{III}_xCl^I_y\)
=> Theo quy tắc hóa trị, ta có: x.III = y.I
=> \(\dfrac{x}{y}=\dfrac{I}{III}=\dfrac{1}{3}\)
=> CTHH: AlCl3
Đúng 8
Bình luận (0)
ta có : số hạt mạng điện tích ở X nhiều hơn số hạt ko mạng điện tích là 12
=> p+e-n = 12
<=> 2p-n=12 (p=e)
<=> n = 2p - 12 (1)
mà tổng số hạt ở X là 40
=> 2p+n=40 (2)
thay (1)vào (2) ta đc
2p+2p-12 = 40
<=> 4p = 52
<=> p = 13
=> X là nhôm : Al
Đúng 2
Bình luận (0)
cho biết tổng số hạt p,n,e trong nguyên tử của nguyên tố X là 40 . trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 12. tìm điện tích hạt nhân z của nguyên tố X
cho biết tổng số hạt p,n,e trong nguyên tử của nguyên tố X là 40 . trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 12. tìm điện tích hạt nhân z của nguyên tố X
Câu 1. Cho các thông tin sau:Ion X2- có cấu hình electron: 1s22s22p63s23p6.Nguyên tố Y có tổng số hạt cơ bản trong nguyên tử là 40. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 12.Ion Z2+ có tổng số hạt mang điện tích dương trong hạt nhân bằng 29.Vị trí của X, Y, Z trong bảng tuần hoàn lần lượt là: A. (X: ô 16, chu kỳ 3, nhóm VIA); ( Y: ô 13, chu kì 3, nhóm IIIA); (Z: ô 29, chu kì 4, nhóm IB).B. (X: ô 16, chu kỳ 3, nhóm VIA); ( Y: ô 13, chu kì 3, nhóm IA); (Z: ô 29...
Đọc tiếp
Câu 1. Cho các thông tin sau:
Ion X2- có cấu hình electron: 1s22s22p63s23p6.
Nguyên tố Y có tổng số hạt cơ bản trong nguyên tử là 40. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 12.
Ion Z2+ có tổng số hạt mang điện tích dương trong hạt nhân bằng 29.
Vị trí của X, Y, Z trong bảng tuần hoàn lần lượt là:
A. (X: ô 16, chu kỳ 3, nhóm VIA); ( Y: ô 13, chu kì 3, nhóm IIIA); (Z: ô 29, chu kì 4, nhóm IB).
B. (X: ô 16, chu kỳ 3, nhóm VIA); ( Y: ô 13, chu kì 3, nhóm IA); (Z: ô 29, chu kì 4, nhóm IIB).
C. (X: ô 20, chu kỳ 4, nhóm IIA); ( Y: ô 13, chu kì 3, nhóm IIIA); (Z: ô 29, chu kì 4, nhóm IB).
D. (X: ô 16, chu kỳ 3, nhóm VIA); ( Y: ô 13, chu kì 3, nhóm IIIA); (Z: ô 31, chu kì 4, nhóm IIIA).
X có cấu hình Electron: \(1s^22s^22p^63s^23p^4\) \(\rightarrow\) X thuộc ô 16, chu kì 3, nhóm VIA
Y có: \(\left\{{}\begin{matrix}p+e+n=40\\p+e-n=12\end{matrix}\right.\) \(\Rightarrow\) \(\left\{{}\begin{matrix}p=e=13\\n=14\end{matrix}\right.\) có cấu hình Electron \(1s^22s^22p^63s^23p^1\) \(\Rightarrow\) Y thuộc ô số 13, chu kì 3, nhóm IIIA
\(Z^{2+}\) có: p = 29 \(\Rightarrow\) p của Z cũng bằng 29 (= e) nên p có cấu hình electron: \(1s^22s^22p^63s^23p^64s^13d^{10}\)
Suy ra Z thuộc ô 29, chu kì 4, nhóm IB.
Chọn câu A.
Đúng 1
Bình luận (0)





















