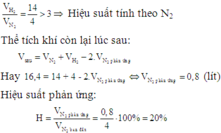Đốt 12,395 lít khí hydrogen tác dụng trong bình chứa 9,916 lít khí oxygen thu được 0,4 mol nước .Tính hiệu suất phản ứng.

Những câu hỏi liên quan
Đốt cháy hoàn toàn 2 gam khí Hydrogen trong không khí người ta thu được 18 gam hơi nước. Biết rằng hydrogen cháy là tác dụng với khi oxygen có trong không khi A) lập phương trình hóa học của phản ứng B) tính khối lượng khí oxygen đã tham gia phản ứng? C) tính thể tích khí oxygen ở điều kiện chuẩn đã tham gia phản ứng? Biết 1 khí ở điều kiện chuẩn (t°=25°C, p=1 bar)
a)
$2H_2 + O_2 \xrightarrow{t^o} 2H_2O$
b) Bảo toàn khối lượng :$m_{H_2} + m_{O_2} = m_{H_2O}$
$\Rightarrow m_{O_2} = 18 - 2 = 16(gam)$
c) $n_{O_2} = \dfrac{16}{32} = 0,5(mol)$
$\Rightarrow V_{O_2} = 0,5.24,79 = 12,395(lít)$
Đúng 2
Bình luận (0)
cho Zn tác dụng vừa đủ với dung dịch HCl. Sau phản ứng thu được 2.479 lít khí H Đốt cháy hết lượng khí hydrogen sinh ra thì cần bao nhiêu thể tích khí oxygen (đkc)
\(n_{H_2}=\dfrac{2,479}{24,79}=0,1mol\)
\(2H_2+O_2\rightarrow\left(t^o\right)2H_2O\)
0,1 0,05 ( mol )
\(V_{O_2}=0,05.24,79=1,2395l\)
Đúng 7
Bình luận (0)
Bài 15: a) Điện phân 22,5 gam nước thu được 12,395 lít khí O2 (đkc). Tính hiệu suất của phản ứng. b) Để tổng hợp được 81 gam nước từ khí H2 và khí O2. Tính thể tích khí H2 cần dùng, biết hiệu suất phản ứng đạt 90% c) Tính khối lượng nước cần dùng để thu được 30,9875 lít khí H2(đkc) bằng phương pháp điện phân, biết hiệu suất phản ứng 75%.
Đọc tiếp
Bài 15: a) Điện phân 22,5 gam nước thu được 12,395 lít khí O2 (đkc). Tính hiệu suất của phản ứng.
b) Để tổng hợp được 81 gam nước từ khí H2 và khí O2. Tính thể tích khí H2 cần dùng, biết hiệu suất phản ứng đạt 90%
c) Tính khối lượng nước cần dùng để thu được 30,9875 lít khí H2(đkc) bằng phương pháp điện phân, biết hiệu suất phản ứng 75%.
Bài 15:
a) \(n_{O_2}=\dfrac{12,395}{24,79}=0,5\left(mol\right)\)
PTHH: 2H2O --đp--> 2H2 + O2
1<--------------0,5
=> \(H=\dfrac{1.18}{22,5}.100\%=80\%\)
b) \(n_{H_2O}=\dfrac{81}{18}=4,5\left(mol\right)\)
PTHH: 2H2 + O2 --to--> 2H2O
4,5<------------4,5
=> \(V_{H_2\left(lý.thuyết\right)}=4,5.24,79=111,555\left(l\right)\)
=> \(V_{H_2\left(tt\right)}=\dfrac{111,555.100}{90}=123,95\left(l\right)\)
c) \(n_{H_2}=\dfrac{30,9875}{24,79}=1,25\left(mol\right)\)
PTHH: 2H2O --đp--> 2H2 + O2
1,25<-------1,25
=> \(m_{H_2O\left(lý.thuyết\right)}=1,25.18=22,5\left(g\right)\)
=> \(m_{H_2O\left(tt\right)}=\dfrac{22,5.100}{75}=30\left(g\right)\)
Đúng 5
Bình luận (0)
Bài 15: a) Điện phân 22,5 gam nước thu được 12,395 lít khí O2 (đkc). Tính hiệu suất của phản ứng. b) Để tổng hợp được 81 gam nước từ khí H2 và khí O2. Tính thể tích khí H2 cần dùng, biết hiệu suất phản ứng đạt 90% c) Tính khối lượng nước cần dùng để thu được 30,9875 lít khí H2(đkc) bằng phương pháp điện phân, biết hiệu suất phản ứng 75%.
Đọc tiếp
Bài 15: a) Điện phân 22,5 gam nước thu được 12,395 lít khí O2 (đkc). Tính hiệu suất của phản ứng.
b) Để tổng hợp được 81 gam nước từ khí H2 và khí O2. Tính thể tích khí H2 cần dùng, biết hiệu suất phản ứng đạt 90%
c) Tính khối lượng nước cần dùng để thu được 30,9875 lít khí H2(đkc) bằng phương pháp điện phân, biết hiệu suất phản ứng 75%.
\(n_{H_2O}=\dfrac{22,5}{18}=1,25\left(mol\right)\)
\(n_{O_2}=\dfrac{12,395}{24,79}=0,5mol\)
\(2H_2O\rightarrow\left(điện.phân\right)2H_2+O_2\)
1,25 0,5 ( mol ) ( thực tế )
1 0,5 ( mol ) ( lý thuyết )
\(H=\dfrac{1}{1,25}.100=80\%\)
b.\(n_{H_2O}=\dfrac{81}{18}=4,5\left(mol\right)\)
\(2H_2+O_2\rightarrow\left(t^o\right)2H_2O\)
4,5 4,5 ( mol )
\(V_{H_2}=4,5.24,79:90\%=123,95l\)
c.\(n_{H_2}=\dfrac{30,9875}{24,79}=1,25mol\)
\(2H_2O\rightarrow\left(điện.phân\right)2H_2+O_2\)
1,25 1,25 ( mol )
\(m_{H_2O}=1,25.18:75\%=30g\)
Đúng 4
Bình luận (0)
Câu 1: Đốt cháy 4,8 g cacbon bằng 7,437 lít khí oxi (đkc) thu được sản phẩm sau phản ứng là CO2. Cho biết chất nào còn dư sau phản ứng và dư bao nhiêu gam. Tính thể tích khí CO2 thu được (đkc)Câu 2: Cho 2,4 g Mg tác dụng với 9,916 lít Cl2 thu được MgCl2. Cho biết chất nào còn dư sau phản ứng và dư bao nhiêu gam. Tính Khối lượng MgCl2 thu được.
Đọc tiếp
Câu 1: Đốt cháy 4,8 g cacbon bằng 7,437 lít khí oxi (đkc) thu được sản phẩm sau phản ứng là CO2. Cho biết chất nào còn dư sau phản ứng và dư bao nhiêu gam. Tính thể tích khí CO2 thu được (đkc)
Câu 2: Cho 2,4 g Mg tác dụng với 9,916 lít Cl2 thu được MgCl2. Cho biết chất nào còn dư sau phản ứng và dư bao nhiêu gam. Tính Khối lượng MgCl2 thu được.
Câu 1 :
$n_C = \dfrac{4,8}{12} = 0,4(mol) ; n_{O_2} = \dfrac{7,437}{24,79} = 0,3(mol)$$
$C + O_2 \xrightarrow{t^o} CO_2$
Ta thấy :
$n_C : 1 > n_{O_2} : 1$ nên C dư
$n_{C\ pư} = n_{O_2} = 0,3(mol) \Rightarrow m_{C\ dư} = (0,4 - 0,3).12 = 1,2(gam)$
$\Rightarorw V_{CO_2} = V_{O_2} = 7,437(lít)$
Câu 2 :
$n_{Mg} = \dfrac{2,4}{24} = 0,1(mol)$
$n_{Cl_2} = \dfrac{9,916}{24,79} = 0,4(mol)$
$Mg + Cl_2 \xrightarrow{t^o} MgCl_2$
Ta thấy :
$n_{Mg} : 1 < n_{Cl_2} : 1$ nên $Cl_2$ dư
$n_{Cl_2\ pư} = n_{Mg} = 0,1(mol) \Rightarrow m_{Cl_2\ dư} = (0,4 - 0,1).71 = 21,3(gam)$
$n_{MgCl_2}= n_{Mg} = 0,1(mol) \Rightarrow m_{MgCl_2} = 0,1.95 = 9,5(gam)$
Đúng 2
Bình luận (0)
Cho 4 lít khí N2 và 14 lít khí H2 trong bình phản ứng ở nhiệt độ khoảng 4000C, xúc tác. Sau phản ứng thu được 16,4 lít hỗn hợp khí ở cùng điều kiện nhiệt độ, áp suất. Tính hiệu suất của phản ứng? A. 20% B. 80% C. 25% D. 60%
Đọc tiếp
Cho 4 lít khí N2 và 14 lít khí H2 trong bình phản ứng ở nhiệt độ khoảng 4000C, xúc tác. Sau phản ứng thu được 16,4 lít hỗn hợp khí ở cùng điều kiện nhiệt độ, áp suất. Tính hiệu suất của phản ứng?
A. 20%
B. 80%
C. 25%
D. 60%
Đốt cháy hoàn toàn 6,2 gam photpho trong bình chứa 8,96 lít khí oxi (ở đktc) thu được điphotpho pentaoxit (P2O5).
(a) Sau phản ứng chất nào còn dư và dư bao nhiêu mol?
(b)Tính khối lượng P2O5 thu được.
(c) Nếu hiệu suất phản ứng là 80% thì khối lượng P2O5 thu được là bao nhiêu?
giúp e với ạ , e cảm ơn
\(n_P=\dfrac{6,2}{31}=0,2\left(mol\right)\\ n_{O_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\\ PTHH:4P+5O_2\underrightarrow{t^o}2P_2O_5\\ LTL:\dfrac{0,2}{4}< \dfrac{0,4}{5}\Rightarrow O_2dư\)
\(n_{O_2\left(pư\right)}=\dfrac{5}{4}n_P=\dfrac{5}{4}.0,2=0,25\left(mol\right)\\ n_{O_2\left(dư\right)}=0,4-0,25=0,15\left(mol\right)\)
\(n_{P_2O_5\left(lt\right)}=\dfrac{1}{2}n_P=\dfrac{1}{2}.0,2=0,1\left(mol\right)\\ m_{P_2O_5\left(lt\right)}=0,1.142=14,2\left(g\right)\\ m_{P_2O_5\left(tt\right)}=0,1.142.80\%=11,36\left(g\right)\)
Đúng 6
Bình luận (0)
Cho m (gam) phản ứng vừa đủ với dung dịch HCL thu được 9,916 lít khí H2 ở đkc.
a) tính m.
b) tính khối lượng muối tạo thành.
c) Đốt cháy toàn bộ lượng khí sinh ra ở trên thì cần phải dùng ít nhất bao nhiêu lít không khí ở đkc ? biết khí oxygen chiếm 20% thể tích không khí
a)\(n_{H_2}=\dfrac{9,916}{24,79}=0,4\left(m\right)\)
\(PTHH:Zn+2HCl\xrightarrow[]{}ZnCl_2+H_2\)\
tỉ lệ :1 2 1 1
số mol :0,4 0,8 0,4 0,4
\(m_{Zn}=0,4.65=26\left(g\right)\)
b)\(m_{ZnCl_2}=0,4.136=54,4\left(g\right)\)
c)(phương trình cho H2 mà cho oxygen 20% thể tích không khí bạn, chắc là thiếu đề rồi)
Đúng 1
Bình luận (6)
đốt cháy 1 mol khí hydrogen trong 0,4 mol khí oxygen đến khi phản ứng xảy ra hoàn toàn.cho biết chất nào còn dư sau phản ứng?