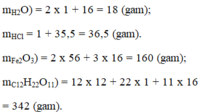Khối lượng của 1,8066 phân tử Fe2O3

Những câu hỏi liên quan
TỔ 4Câu 1: Hãy tính khối lượng của những lượng chất sau:(a) 0,75 mol phân tử H2S; 0,025 mol phân tử CaSO4; 0,05 mol phân tử Fe2O3.Câu 2: Hãy tính thể tích (ở đktc) của những lượng chất sau:(a) 2,5 mol phân tử N2; 0,03 mol phân tử H2; 0,45 mol phân tử O2.(b) Hỗn hợp 0,2 mol phân tử O2 và 0,25 mol phân tử N2.
Đọc tiếp
TỔ 4
Câu 1: Hãy tính khối lượng của những lượng chất sau:
(a) 0,75 mol phân tử H2S; 0,025 mol phân tử CaSO4; 0,05 mol phân tử Fe2O3.
Câu 2: Hãy tính thể tích (ở đktc) của những lượng chất sau:
(a) 2,5 mol phân tử N2; 0,03 mol phân tử H2; 0,45 mol phân tử O2.
(b) Hỗn hợp 0,2 mol phân tử O2 và 0,25 mol phân tử N2.
Câu 1:
\(m_{H_2S}=0,75.34=25,5(g)\\ m_{CaSO_4}=0,025.136=3,4(g)\\ m_{Fe_2O_3}=0,05.160=8(g)\)
Câu 2:
\(V_{N_2}=2,5.22,4=56(l)\\ V_{H_2}=0,03.22,4=0,672(l)\\ V_{O_2}=0,45.22,4=10,08(l)\\ V_{hh}=22,4.(0,2+0,25)=22,4.0,45=10,08(l)\)
Đúng 1
Bình luận (0)
Em hãy cho biết khối lượng của N phân tử những chất sau: H 2 O , H C l , F e 2 O 3 ; C 12 H 22 O 11 .
Em hãy cho biết khối lượng của N phân tử những chất sau:
H2O, HCl, Fe2O3, C12H22O11
MH2O = (2.1 + 16) = 18g.
MHCl = (1+35,5) = 36,5g.
MFe2O3 = 2.56 + 16.3 = 160g.
MC12H22O11 = 12.12 + 22.1 + 16.11 = 342g.
Đúng 0
Bình luận (0)
Công thức hóa học của iron(III) oxide là Fe2O3, hãy cho biết thành phần nguyên tố, số lượng nguyên tử của mỗi nguyên tố và tính khối lượng phân tử
- Thành phần nguyên tố: Fe, O
- Số lượng nguyên tử: 2 nguyên tử Fe, 3 nguyên tử O
\(m_{Fe_2O_3}=2.56+3.16=160\left(amu\right)\)
Đúng 0
Bình luận (0)
Tính khối lượng của những chất sau:
a) 1 mol nguyên tử O ; 1 mol phân tử O2.
b) 1,5 mol nguyên tử Fe ; 1,5 mol phân tử Fe2O3.
c) 0,25 mol nguyên tử N ; 2,5 mol phân tử NO2.
d) 1 mol phân tử glucozơ C6H12O6
\(a.m_O=1.16=16\left(g\right)\\ m_{O_2}=1.32=32\left(g\right)\\ b.m_{Fe}=1,5.56=84\left(g\right)\\ m_{Fe_2O_3}=1,5.160=240\left(g\right)\\ c.m_N=0,25.14=3,5\left(g\right)\\ m_{NO_2}=2,5.46=115\left(g\right)\\ d.m_{C_6H_{12}O_6}=1.180=180\left(g\right)\)
Đúng 1
Bình luận (0)
a,mo=16. mo2=32
b,mfe=1,5x56=84. mfe2o3=1,5x(56x2+16x3)=195
Đúng 0
Bình luận (0)
c, mn= 0,25x14=3,5. mno2=2,5x(14+16x2)=115
Đúng 0
Bình luận (0)
Hợp chất X có khối lượng mol phân tử là 232 g/mol, thành phần phần trăm khối lượng của Fe là 72,41%, còn lại là của O. Công thức hóa học của X là
FeO.
Fe3O2.
Fe3O4.
Fe2O3.
Gọi CTHH của X là: \(Fe_xO_y\)
Ta có: \(\%_O=100\%-72,41\%=27,59\%\)
\(\Rightarrow x:y=\dfrac{72,41\%}{56}:\dfrac{27,59\%}{16}=1,293:1,724\approx1:1\)
Vậy CTHH của X là: \(FeO\)
Vì công thức hóa học của sắt oxit không theo tỉ lệ giống nhau, trừ FeO nên không cần khối lượng mol
Đúng 5
Bình luận (0)
Câu 6. Một oxit của sắt có thành phần phần trăm theo khối lượng của Fe bằng 70%. Biết phân tử khối của oxit bằng 160đvC. Công thức hoá học của oxit là:A. FeO B. Fe3O4 C. Fe2O3 D. Cả A và B đúngCâu 7. Để tách riêng Fe2O3 ra khỏi hỗn hợp BaO và Fe2O3 ta dùng:A. NướC. B.Giấy quì tím. C. Dung dịch HCl. D. Dung dịch NaOH.Câu 8. Để loại bỏ khí CO2 có...
Đọc tiếp
Câu 6. Một oxit của sắt có thành phần phần trăm theo khối lượng của Fe bằng 70%. Biết phân tử khối của oxit bằng 160đvC. Công thức hoá học của oxit là:
A. FeO B. Fe3O4 C. Fe2O3 D. Cả A và B đúng
Câu 7. Để tách riêng Fe2O3 ra khỏi hỗn hợp BaO và Fe2O3 ta dùng:
A. NướC. B.Giấy quì tím. C. Dung dịch HCl. D. Dung dịch NaOH.
Câu 8. Để loại bỏ khí CO2 có lẫn trong hỗn hợp (O2, CO2), ta cho hỗn hợp đi qua dung dịch
A. HCl B. Ca(OH)2 C. Na2SO4 D. NaCl
Câu 9. Vôi sống có công thức hóa học là :
A. Ca B. Ca(OH)2 C. CaCO3 D. CaO
Câu 10. Dãy gồm các kim loại tác dụng được với dung dịch H2SO4 loãng là:
A. Fe, Cu, Mg. B. Zn, Fe, Cu.
C. Zn, Fe, Al. D. Fe, Zn, Ag
Câu 11. Chất tác dụng với dung dịch HCl tạo thành chất khí có mùi sốc, nặng hơn không khí là
A. Mg B. CaCO3 C. MgCO3 D. Na2SO3
Câu 12. Thuốc thử dùng để nhận biết dung dịch NaCl và dung dịch K2SO4 là:
A. K2SO4 B. Ba(OH)2 C. FeCl2 D. NaOH
Câu 13. Khi cho từ từ dung dịch HCl đến dư vào ống nghiệm đựng dung dịch hỗn hợp gồm NaOH và một ít phenolphtalein. Hiện tượng quan sát được trong ống nghiệm là:
A. Màu đỏ mất dần. B. Không có sự thay đổi màu sắc
C. Màu đỏ từ từ xuất hiện. D. Màu xanh từ từ xuất hiện.
Câu 14. Khi trộn lẫn dung dịch X chứa 1 mol HCl vào dung dịch Y chứa 1,5 mol NaOH được dung dịch Z. Dung dịch Z làm quì tím chuyển thành:
A. Màu đỏ B. Màu xanh C. Không màu D. Màu tím
Câu 15. Cho phản ứng: BaCO3 + 2X ![]() H2O + Y + CO2. X và Y lần lượt là:
H2O + Y + CO2. X và Y lần lượt là:
A. H2SO4 và BaSO4 B. HCl và BaCl2
C. H3PO4 và Ba3(PO4)2 D. H2SO4 và BaCl2
Câu 16. Dung dịch A có pH < 7 và tạo ra kết tủa khi tác dụng với dung dịch Bari nitrat Ba(NO3)2 . Chất A là:
A. HCl B. Na2SO4 C. H2SO4 D. Ca(OH)2
Câu 17. Dùng thuốc thử nào sau đây để nhận biết các chất chứa trong các ống nghiệm mất nhãn: HCl, KOH, NaNO3, Na2SO4.
A. Dùng quì tím và dd CuSO4. B. Dùng dd phenolphtalein và dd BaCl2.
C. Dùng quì tím và dd BaCl2. D. Dùng dd phenolphtalein và dd H2SO4.
Câu 18. Cho 6,5g kẽm vào dung dịch axit clohiđric dư. Khối lượng muối thu được là
A. 13,6 g B. 1,36 g C. 20,4 g D. 27,2 g
Câu 19. Muốn pha loãng axit sunfuric đặc, ta phải:
A. Rót nước vào axit đặc. B. Rót từ từ nước vào axit đặc.
C. Rót nhanh axit đặc vào nước. D. Rót từ từ axit đặc vào nước.
Câu 20. Khi nhỏ từ từ H2SO4 đậm đặc vào đường chứa trong cốc hiện tượng quan sát được là:
A. Sủi bọt khí, đường không tan.
B. Màu trắng của đường mất dần, không sủi bọt.
C. Màu đen xuất hiện và có bọt khí sinh ra.
D. Màu đen xuất hiện, không có bọt khí sinh ra.
Câu 21. Để làm sạch dung dịch FeCl2 có lẫn tạp chất CuCl2 ta dùng:
A. H2SO4 . B. HCl. C. Al. D. Fe.
Câu 22. Chỉ dùng dung dịch NaOH có thể phân biệt được cặp kim loại
A. Fe, Cu . B. Mg, Fe. C. Al, Fe. D. Fe, Ag.
Câu 23. Phản ứng giữa dung dịch Ba(OH)2 và dung dịch H2SO4 (vừa đủ) thuộc loại:
A. Phản ứng trung hoà . B. Phản ứng thế.
C. Phản ứng hoá hợp. D. Phản ứng oxi hoá – khử.
Câu 24. Nhôm hoạt động hoá học mạnh hơn sắt, vì:
A. Nhôm và sắt đều không phản ứng với HNO3 đặc nguội.
B. Nhôm có phản ứng với dung dịch kiềm.
C. Nhôm đẩy được sắt ra khỏi dung dịch muối sắt.
D. Chỉ có sắt bị nam châm hút.
Câu 25. Cho 11,2 g sắt tác dụng với axit sunfuric loãng, dư. Thể tích khí H2 thu được (ở đktc) là
A. 1,12 lít. B. 2,24 lít. C. 3,36 lít. D. 4,48 lít.
Câu 26. Trong sơ đồ phản ứng sau: ![]() . M là:
. M là:
A. Cu . B. Cu(NO3)2. C. CuO. D. CuSO4.
Câu 27. Trung hoà 100ml dung dịch H2SO4 1M bằng V ml dung dịch KOH 1M. Giá trị của V là:
A. 50 ml . B. 200 ml. C. 300 ml. D. 400 ml.
Câu 28. Dãy các bazơ nào sau đây không bền với nhiệt?
A. Cu(OH)2; Zn(OH)2; Al(OH)3; Mg(OH)2
B. Cu(OH)2; Zn(OH)2; Al(OH)3; NaOH
C. Fe(OH)3; Cu(OH)2; KOH; Mg(OH)2
D. Fe(OH)3; Cu(OH)2; Ba(OH)2; Mg(OH)2
Câu 29. Dung dịch KOH không có tính chất hoá học nào sau đây?
A. Làm quỳ tím hoá xanh
B. Tác dụng với oxit axit tạo thành muối và nước
C. Tác dụng với axit tạo thành muối và nước
D. Bị nhiệt phân huỷ tạo ra oxit bazơ và nước
Câu 30. Kim loại nào sau đây vừa phản ứng với dung dịch axit, vừa phản ứng với bazơ kiềm?
A. Mg B. Al C. Fe D. Cu
6. C
7. A
8. B
9. D
10. C
11. D
12. B
13. A
14. B
15. B
16. C
17. C
18. A
19. D
20. C
21. D
22. C
23. A
24. C
25. D
26. (không thấy sơ đồ)
27. B
28. A
29. D
30. B
Đúng 1
Bình luận (0)
Cho sơ đồ phản ứng sau :
F
e
2
O
3
+
C
O
−
t
o
→
F
e
+
C
O
2
Lập phương trình hóa họcKhi cho 16,8 kg CO tác dụng với 32 kg
F
e
2
O
3
tạo ra 26,4 kg
C
O
2
, tính khối lượn...
Đọc tiếp
Cho sơ đồ phản ứng sau :
F e 2 O 3 + C O − t o → F e + C O 2
Lập phương trình hóa học
Khi cho 16,8 kg CO tác dụng với 32 kg F e 2 O 3 tạo ra 26,4 kg C O 2 , tính khối lượng sắt thu được.
Hãy cho biết tỉ lệ số nguyên tử, phân tử của các chát trong phản ứng trên.
Cho sơ đồ phản ứng sau : Fe2O3 + CO −to→ Fe + CO2
a) Lập phương trình hóa học
b) Hãy cho biết tỉ lệ số nguyên tử, phân tử của các chát trong phản ứng trên.
c) Cho 16,8 kg CO tác dụng với 32 kg Fe2O3 tạo ra 26,4 kg CO2, tính khối lượng sắt thu được
a) \(Fe_2O_3+3CO-^{t^o}\rightarrow2Fe+3CO_2\)
b) Tỉ lệ : 1 :3 : 2:3
c)C1 : \(n_{Fe}=\dfrac{2}{3}n_{CO_2}=0,4\left(mol\right)\)
=> \(m_{Fe}=0,4.56=22,4\left(kg\right)\)
C2: Bảo toàn khối lượng : \(m_{Fe}=m_{CO}+m_{Fe_2O_3}-m_{CO_2}=22,4\left(kg\right)\)
Đúng 1
Bình luận (0)