cho m gam feso4 vào 250 ml dd feso4 1,2m thu được dung dịch feso4 1,5M (khi thêm chất tan , Vdd thay đổi ko đáng kể)
a. tính số mol feso4 trong cả 2 dung dịch trên
b. tính m
a. Tính số ml nước cần dùng để hòa tan 27,8 gam FeSO4.7H2O để thu được dung dịch FeSO4 9%. Cho biết khối lượng riêng của nước là 1g/ml
b. Tính số gam FeSO4.7H2O cần cho thêm vào dung dịch FeSO4 9% ở trên để thu được dung dịch FeSO4 20%
m FeSO4=\(\dfrac{27,8.152}{278}=15,2g\)
=>m dd=\(\dfrac{15,2}{\left(9\%\right)}=\dfrac{1520}{9}\)
m H2O=\(\dfrac{1520}{9}\)-27,8=141g
->Vh2O=141ml
b)m muối = x (g)
m FeSO4=\(15,2+\dfrac{152x}{278}=20\%\left(x+\dfrac{1520}{9}\right)\)
=>x=53,57g
Cho m (g) FeSO4 vào 250 (ml) dung dịch FeSO4 1,2M thu được dung dịch FeSO4 1,5M (khi thêm chất tan, thể tích dung dịch thay đổi không đáng kể)
a) Tính số mol FeSO4 trong cả hai dung dịch trên
b) Tính m
,m(g)FeSO4 :x(mol) vào FeSO4 (0,3 mol) đk: FeSO4 (0,375 mol) Ad: bảo toàn ng tố →x=0,075mol,→m(g)=0,075\(\times\)152=11,4g
hoà tan 10g muối Feso4 bị hút ẩm vào nước thu được 250ml dung dịch A.Lấy 20ml A thêm H2so4 để tạo môi trường axit rồi cho tác dụng dung dịch KMnO4 0,04 M thì cần vừa đúng 25ml.Hãy tính nồng độ mol của dung dịch và hàm lượng Feso4 khan trong mẫu trên
Hòa tan hoàn toàn 53,6 gam hỗn hợp A gồm (FeO, CuO) cần dùng vừa đủ 500 ml dung dịch H 2 S O 4 1,4M (D = 1,2g/ml) thu được dung dịch X. Giả thiết thể tích của dung dịch sau phản ứng thay đổi không đáng kể. Nồng độ phần trăm của muối F e S O 4 trong dung dịch X là
A. 7,04%
B. 6,06%
C. 9,30%
D. 6,98%
Chọn D
Gọi số mol của FeO và CuO lần lượt là x và y mol
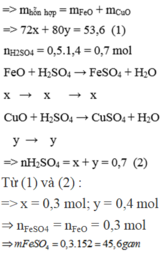
Ta có: m d d H 2 S O 4 = D . V = 1 , 2 . 500 = 600 g a m
Vì phản ứng không tạo ra chất khí hay kết tủa nên:
m d d s a u p ư = m t r ư ớ c p ư = m h h A + m d d a x i t = 53 , 6 + 600 = 653 , 6 g a m .
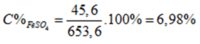
Cho 20,55 gam Ba vào 100 ml dung dịch F e S O 4 1,5M. Sau phản ứng thu được m gam kết tủa bằng?
A. 24,35
B. 34,95
C. 48,45
D. 40,25
Ngâm 18,6 gam hỗn hợp Zn, Fe trong 250 ml dung dịch FeSO4 ( vừa đủ). Kết thúc phản ứng thu được 16,8 gam Fe.
a) Tính thành phần % khối lượng mỗi kim loại trong hỗn hợp.
b) Xác định nồng độ mol của dung dịch FeSO4.
Tính khối lượng chất tan trong mỗi trường hợp sau : a. 200 gam dung dịch HCL 7,3% b. 500ml dung dịch NaOH 1M c. 200ml dung dịch CuSO4 1,5M d.Xác định khối lượng CuSO4. 5H2O cần để khi hoà tan vào 375 gam Nước thì được dung dịch FeSO4 4%
a) \(m_{HCl}=200\cdot7,3\%=14,6\left(g\right)\)
b) \(n_{NaOH}=0,5\cdot1=0,5\left(mol\right)\) \(\Rightarrow m_{NaOH}=0,5\cdot40=20\left(g\right)\)
c) \(n_{CuSO_4}=0,2\cdot1,5=0,3\left(mol\right)\) \(\Rightarrow m_{CuSO_4}=0,3\cdot160=48\left(g\right)\)
d) Bạn xem lại đề !
a) mHCl=200⋅7,3%=14,6(g)mHCl=200⋅7,3%=14,6(g)
b) nNaOH=0,5⋅1=0,5(mol)nNaOH=0,5⋅1=0,5(mol) ⇒mNaOH=0,5⋅40=20(g)⇒mNaOH=0,5⋅40=20(g)
c) nCuSO4=0,2⋅1,5=0,3(mol)nCuSO4=0,2⋅1,5=0,3(mol) ⇒mCuSO4=0,3⋅160=48(g)⇒mCuSO4=0,3⋅160=48(g)
d) Bạn xem lại đề !
Hòa tan 1,0 gam quặng crom trong axit, oxi hóa Cr3+ thành CrO72-. Sau khi đã phân hủy hết lượng dư chất oxi hóa, pha loãng dung dịch thành 100ml. Lấy 20 ml dung dịch này cho vào 25 ml dung dịch FeSO4 trong H2SO4. Chuẩn độ lượng dư FeSO4 hết 7,50 ml dung dịch chuẩn K2Cr2O7 0,0150M. Biết rằng 25 ml FeSO4 tương đương với 35 ml dung dịch chuẩn K2Cr2O7. Thành phần % của crom trong quặng là:
A. 10,725%
B. 13,65%
C. 21,45%
D. 26%
Đáp án C
6FeSO4 + K2Cr2O7 + 7H2SO4 → 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
n FeSO 4 dư = 0,0075.0,015 = 1,125. 10 - 4 mol
25 ml FeSO4 tương đương với 35 ml dung dịch chuẩn K2Cr2O7
=> n K 2 Cr 2 O 7 phản ứng = 35 - 7 , 5 1000 . 0 , 015 = 4 , 125 . 10 - 4 mol
⇒ n Cr ( quặng ) = 2 n K 2 Cr 2 O 7 phải ứng . 100 20 = 4 , 125 . 10 - 3 mol
⇒ % m Cr ( quặng ) = 52 . 4 , 125 . 10 - 3 1 . 100 % = 21 , 45 %
Hòa tan m gam FeSO4 vào nước được dung dịch A. Cho nước Clo dư vào dd A, sau khi phản ứng kết thúc thu được dd B. Cô cạn dd A thu được m+6,39 gam hh 2 muối khan. Nếu hòa tan m gam FeSO4 vào dd H2SO4 loãng dư thì dd thu được này làm mất màu vừa dủ bao nhiêu ml dd KMnO4 1M?.