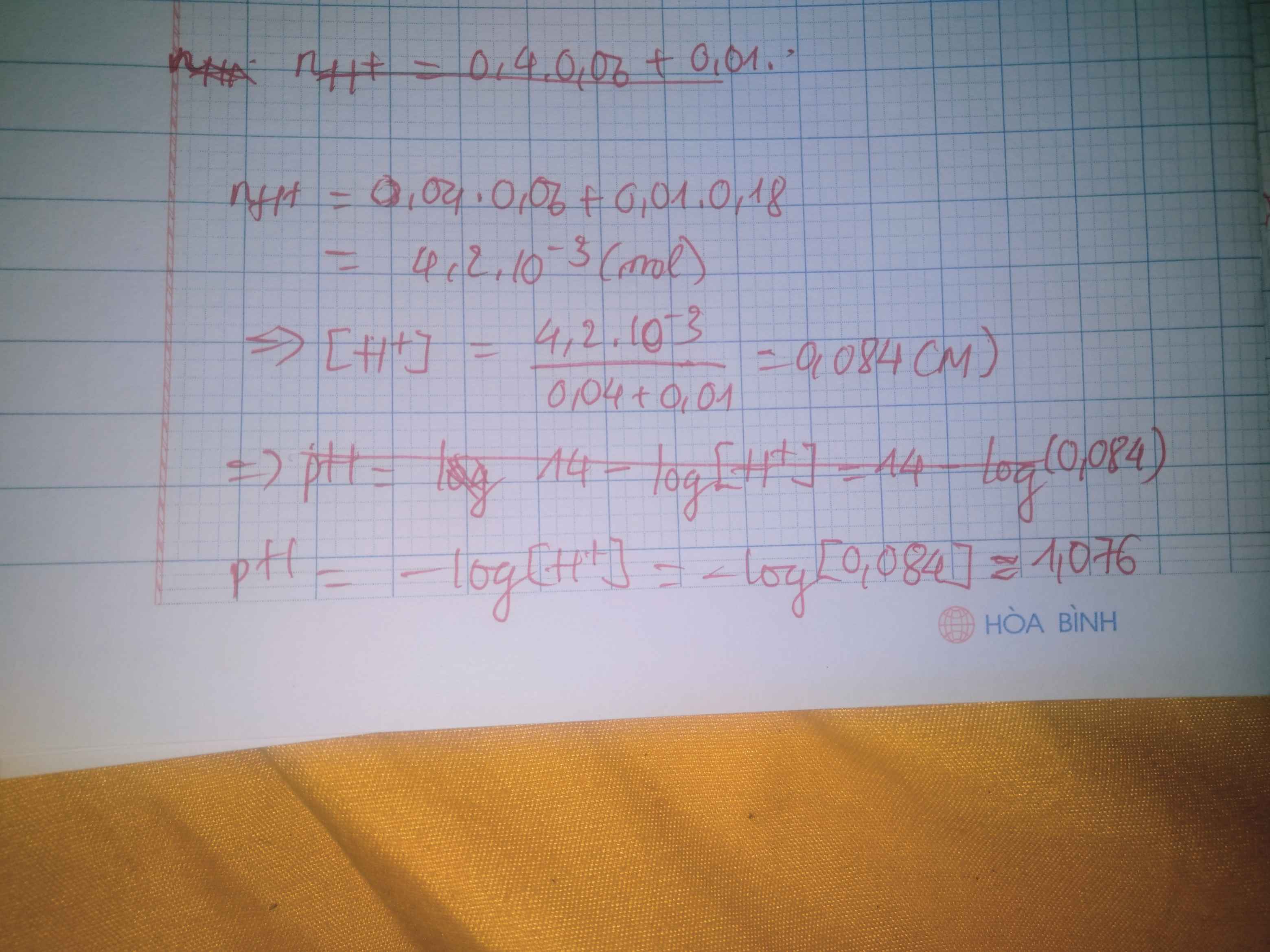cho 10ml dd HCl có pH=3.Hãy đề nghị cách pha dd có pH=4 từ dd trên

Những câu hỏi liên quan
Pha loãng dd HCL có pH=3 bao nhiêu lần để được dd mới có pH=4?
\(\left[H+\right]\) ban đầu \(=10^{-3}=0,001\)
\(\left[H+\right]\) lúc sau \(=10^{-4}=0,0001\)
Ta có :
\(\left[H+\right]\) ban đầu \(\times\) \(V\) ban đầu = \(\left[H+\right]\) lúc sau \(\times\) \(V\) sau
\(\frac{Vsau}{Vđầu}=\frac{\left[H+\right]đầu}{\left[H+\right]sau}=\frac{0,001}{0,0001}=10\) lần
Đúng 0
Bình luận (0)
Cho 40ml dd HNO3 0,06M vào 10ml dd HCl 0,18M. Tính pH
cách pha 500ml dd ch3cooh 2N từ dd ch2cooh 30% , d = 1,05g
pha 500ml dd Hcl 0,1M từ dung dịch Hcl 36% có d = 1,18g/ml
Pha 500ml dd h2so4 4N từ dd h2so4 98% , d = 1,84g/ml
Pha loãng 10ml dd HCl có pH=13 với bao nhiêu ml nước để được đúng dịch pH=11
pH = 13 ➝ pOH = 14 - 13 = 1
\(\left[OH^-\right]\)= 10-1 = 0,1M
=> n\(OH^-\) = 0,1.0,01 = 0,001(mol)
Để pH = 11 ➝ pOH = 14 - 11 = 3
\(\left[OH^-\right]\)= 10-3 = 0,001 M
=> V = \(\frac{0,001}{0,001}\) = 1(l)
=> Thể tích cần tìm :
1 - 0,01 = 0,99(l)
2. Cho dd Ba(OH)2 có pH =12 , nồng độ mol/l của Ba(OH)2 là?
9.
10ml dd NaOH có pH=13 cần pha chế thêm bao nhiêu lần nước để thu đc dd có pH =12?
10. Trộn 300ml dd H2SO4 có pH =2 vs 200ml dd H2SO4 có pH=3 thì thu đc dd có pH là?
1)
Dung dịch có pH = 12 suy ra pOH = 2.
=> [OH−]=10−2M
=> CM Ba(OH)2=1/2[OH−] = 0,005M
2)
Dung dịch có pH = 13 suy ra pOH = 1.
=> [OH− ]=10−1 = 0,1M
=> nOH−=0,01.0,1 = 0,001M
Dung dịch sau pha loãng có pH = 12 suy ra pOH = 2.
=> [OH−] = 10−2 => Vdd = 0,001/10−2 = 0,1 lít
VH2O = 100 − 10 = 90 ml
3)
Dung dịch 1 có [H+] = 10 − 2 => nH+ = 0,3.10 − 2 = 3.10−3 mol
Dung dịch 2 có [H+] = 10 − 3 => nH+ = 0,2.10− 3 = 2.10−4 mol
Trộn 2 dung dịch được dung dịch có thể tích là
V = 300 + 200 = 500 ml = 0,5 lít
nH+ = 3.10 − 3 + 2.10 − 4 = 3,2.10 − 3 mol
[H+] = 3,2.10 − 3/0,5 = 6,4.10 − 3M
=> pH = −log[H+] = 2,194
Cho từ từ dd HCl vào dd Na2CO3 (tỉ lệ 3:1). Dung dịch thu được có: A. pH=7 B. pH>7 C. pH
$Na_2CO_3 + HCl \to NaHCO_3 + NaCl$
$NaHCO_3 + HCl \to NaCl + CO_2 + H_2O$
Ta thấy :
$n_{HCl\ đã\ dùng} = 2n_{Na_2CO_3}$
$\Rightarrow HCl$ dư.
$\Rightarrow pH < 7$
Đúng 2
Bình luận (0)
21. Khi thêm V ml nước cất vào 10ml dd HCl có pH=3 thu đc dd có pH=4. Xác định giá trị của V?
22.Khi thêm V ml nước cất vào 100ml dd NaOh có pH=14 thu đc dd có pH=12. Xác định giá trị của V?
Tính tỉ lệ V1 : V2
a/ Trộn V1 (ml) dd HNO3 (pH = 1) với V2 (ml) dd HNO3 (pH = 3) để được dd có pH = 2.
b/ Pha thêm V1(ml) nước vào V2 (ml) dd NaOH (pH = 13) để được dd có pH = 12
Trộn 10ml dd HCl 0,75 vào 160ml dd chứa đồng thời Ba(OH)2 0,05M và KOH 0,04M. Tính pH của dd thu được