hãy nêu các tính chất hóa học của kim loại và cho thí nghiệm kiểm chứng
Câu 1: Nêu các tính chất hóa học của oxit, axit, bazo, muối. Cho ví dụ.
Câu 2: Trình bày tính chất vật lý, tính chất hóa học chung của kim loại và phi kim. Cho ví dụ.
Câu 3: viết dãy hoạt động hóa học của kim loại và nêu ý nghĩa của dãy hoạt động đó.
Câu 4: Thế nào là hợp kim gang, thép? Cho biết nguyên liệu và nguyên tắc sản xuất gang, thép.
Câu 5: Thế nào là sự ăn mòn kim loại? Nêu những yếu tố ảnh hưởng và các biện pháp chống sự ăn mòn kim loại.
Câu 6: Nêu các tính chất vật lý - tính chất hóa học của Clo, Silic và cách điều chế Clo trong phòng thí nghiệm và trong công nghiệp. Viết PTHH.
Câu 7: Công nghiệp Silicat bao gồm những ngành sản xuất nào? Nêu nguyên liệu và các công đoạn chính của các ngành sản xuất đó.
Câu 8: Các dạng thù hình của một nguyên tố là gì? Nêu cái dạng thù hình, tính chất vật lý của các dạng thù hình Cabon và tính chất hóa học của Cabon. Viết PTHH.
Câu 9: Trình bày tính chất hóa học của Axit Cacbonic, các Oxit của Cacbon và muối Cacbonat. Viết phương trình phản ứng minh họa.
Câu 10: Nêu nguyên tắc sắp xếp, cấu tạo, sự biến đổi tính chất của các nguyên tố và ý nghĩa của bảng hệ thống tuần hoàn các nguyên tố hóa học.
trong phòng thí nghiệm của các hóa chất KMnO4 H2O và các kim loại Cu Fe Al hãy chọn các chất có sẵn để tiến hành thí nghiệm điều chế nhanh các chất MnO2, CO, Fe3O4 , Al2O3 . Các dụng cụ thí nghiệm coi như có đủ
2KMNO4-to>K2MnO4+MnO2+O2
2H2O-đp->2H2+O2
2Cu+O2-to>2CuO
3Fe+2O2-to>Fe3O4
4Al+3O2-to>2Al2O3
phân Hủy KMnO4 tạo ra MnO2
pthh : 2KMnO4 -t-> K2MnO4 + MnO2 + O2
lấy 1 nửa O2 vừa dùng được tác dụng với Fe
pthh : 3Fe + 2O2 -t-> Fe3O4
lấy phần còn lại tác dụng với Al
pthh : 4Al + 3O2 -t-> 2Al2O3
*Thí nghiệm 1:
+) Hiện tượng: Xuất hiện chất rắn màu đỏ, dd màu xanh nhạt dần
+) PTHH: \(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
*Thí nghiệm 2
+) Hiện tượng: Xuất hiện kết tủa trắng
+) PTHH: \(BaCl_2+Na_2SO_4\rightarrow2NaCl+BaSO_4\downarrow\)
*Thí nghiệm 3
a) Hiện tượng: Xuất hiện kết tủa trắng
PTHH: \(AgNO_3+HCl\rightarrow HNO_3+AgCl\downarrow\)
b) Hiện tượng: Chất rắn tan dần, sủi bọt khí
PTHH: \(CaCO_3+2HCl\rightarrow CaCl_2+H_2O+CO_2\uparrow\)
*Thí nghiệm 4: Xem lại đề
*Thí nghiệm 5
+) Hiện tượng: Chất rắn tan dần, dd chuyển sang màu xanh lá cây
+) PTHH: \(CuO+2HCl\rightarrow CuCl_2+H_2O\)
*Thí nghiệm 6
+) Hiện tượng: Kẽm tan dần, xuất hiện khí
+) PTHH: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\uparrow\)
*Thí nghiệm 7
+) Hiện tượng: Nhôm tan dần, xuất hiện khí
+) PTHH: \(Al+NaOH+H_2O\underrightarrow{t^o}NaAlO_2+\dfrac{3}{2}H_2\uparrow\)
Hình vẽ bên mô tả thí nghiệm điều chế và thử tính chất của khí axetilen. Hãy cho biết một cặp chất X, Y phù hợp với thí nghiệm. Nêu hiện tượng xảy ra trong ống nghiệm đựng dung dịch Br2 khi sục khí axetilen từ từ đến dư vào dung dịch Br2. Viết các phương trình hóa học và thử tính chất của axetilen trong thí nghiệm đó.
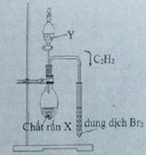
(X, Y) = (CaC2; H2O)
CH≡CH + Br2 → CH(Br2)–CH(Br2)
Dung dịch Br2 nâu đỏ dần nhạt màu rồi mất màu hoàn toàn
1. Cho các chất Na, H2O, CaCO3, KClO3, P và các điều kiện cần thiết. Viết phương trình hóa học điều chế: NaOH, CO2, O2, H3PO4.
2. Nêu hiện tượng của các thí nghiệm sau:
a. Cho kim loại kẽm vào dung dịch axit clohidric
b. Dẫn luồng khí hidro đi qua ống sứ đựng bột đồng (II) oxit nung nóng
1)
- NaOH
2Na + 2H2O --> 2NaOH + H2
- CO2
CaCO3 --to--> CaO + CO2
- O2
2KClO3 --to--> 2KCl + 3O2
- H3PO4
4P + 5O2 --to--> 2P2O5
3H2O + P2O5 --> 2H3PO4
2)
a) Kim loại kẽm tan dần vào dd, có khí không màu thoát ra
Zn + 2HCl --> ZnCl2 + H2
b) Chất rắn màu đen dần chuyển sang màu đỏ
CuO + H2 --to--> Cu + H2O
1)
- NaOH
2Na + 2H2O --> 2NaOH + H2
- CO2
CaCO3 --to--> CaO + CO2
- O2
2KClO3 --to--> 2KCl + 3O2
- H3PO4
4P + 5O2 --to--> 2P2O5
3H2O + P2O5 --> 2H3PO4
2)
a) Kim loại kẽm tan dần vào dd, có khí không màu thoát ra
Zn + 2HCl --> ZnCl2 + H2
b) Chất rắn màu đen dần chuyển sang màu đỏ
CuO + H2 --to--> Cu + H2O
Sự ăn mòn kim loại là sự phá hủy kim loại hoặc hợp kim do tác dụng của các chất trong môi trường xung quanh. Đó là một quá trình hóa học hoặc quá trình điện hóa trong đó kim loại bị oxi hóa thành ion dương.
M → M n + + n e
Có hai dạng ăn mòn kim loại là ăn mòn hóa học và ăn mòn điện hóa học: - Ăn mòn hóa học là quá trình oxi hóa - khử, trong đó các electron của kim loại được chuyển trực tiếp đến các chất trong môi trường.
- Ăn mòn điện hóa học là quá trình oxi hóa - khử, trong đó kim loại bị ăn mòn do tác dụng của dung dịch chất điện li và tạo nên dòng electron chuyển dời từ cực âm đến cực dương.
Thí nghiệm 1: Tiến hành thí nghiệm theo các bước sau: Bước 1: Rót dung dịch H 2 S O 4 loãng vào cốc thủy tinh.
Bước 2: Nhúng thanh kẽm và thanh đồng (không tiếp xúc nhau) vào cốc đựng dung dịch H 2 S O 4 loãng.
Bước 3: Nối thanh kẽm với thanh đồng bằng dây dẫn (có mắc nối tiếp với một điện kế).
Thí nghiệm 2: Để 3 thanh hợp kim: Cu-Fe (1); Fe-C (2); Fe-Zn (3) trong không khí ẩm
Trong Thí nghiệm 2, hợp kim có sắt bị ăn mòn là
A. (1), (2)
B. (2), (3)
C. (1), (3)
D. (1), (2), (3)
trong phòng thí nghiệm chỉ có các hóa chất KMnO4, H2O và các kim loại Cu, Fe, Al hãy chọn các chất có sẵn để tiến hành thí nghiệm điều chế nhanh các chất MnO2, CuO ,Fe304, Al2O3 các dụng cụ thí nghiệm coi như có đủ
2KMnO4-to>MnO2+K2MnO4+O2
2H2O-đp->2H2+O2
2Cu+O2-to>2CuO
3Fe+2O2-to>Fe3O4
4Al+3O2-to>2Al2O3
\(MnO_2:2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\uparrow\\ CuO:2Cu+O_2\underrightarrow{t^o}2CuO\\ Fe_3O_4:3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\\ Al_2O_3:4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
Câu 1: a) Cho các chất sau : P2O5 , ZnO , H2SO4 , CH4 , Fe2O3 , NO , CuSO4 , SO2 , H2CO3 , NaOH
1.chất nào là oxit . phân loại oxit đó?
2. Hãy chỉ ra chất nào là axit , bazo
b) Hãy nêu hiện tượng hóa học xảy ra và viết PTHH khi tiến hành các thí nghiệm sau
1. Nhả dung dịch HCl vào ống nghiệm đựng Cu(OH)2
2. Cho đồng vào ống nghiệm đựng dung dịch H2SO4 đặc , đun nóng
Câu 2: Trình bày TCHH của axit hoặc bazo . Mỗi tính chất nêu 2 vd
MÌNH CẦN TRONG TỐI NI
Sự ăn mòn kim loại là sự phá hủy kim loại hoặc hợp kim do tác dụng của các chất trong môi trường xung quanh. Đó là một quá trình hóa học hoặc quá trình điện hóa trong đó kim loại bị oxi hóa thành ion dương.
M → M n + + n e
Có hai dạng ăn mòn kim loại là ăn mòn hóa học và ăn mòn điện hóa học: - Ăn mòn hóa học là quá trình oxi hóa - khử, trong đó các electron của kim loại được chuyển trực tiếp đến các chất trong môi trường.
- Ăn mòn điện hóa học là quá trình oxi hóa - khử, trong đó kim loại bị ăn mòn do tác dụng của dung dịch chất điện li và tạo nên dòng electron chuyển dời từ cực âm đến cực dương.
Thí nghiệm 1: Tiến hành thí nghiệm theo các bước sau: Bước 1: Rót dung dịch H 2 S O 4 loãng vào cốc thủy tinh.
Bước 2: Nhúng thanh kẽm và thanh đồng (không tiếp xúc nhau) vào cốc đựng dung dịch H 2 S O 4 loãng.
Bước 3: Nối thanh kẽm với thanh đồng bằng dây dẫn (có mắc nối tiếp với một điện kế).
Thí nghiệm 2: Để 3 thanh hợp kim: Cu-Fe (1); Fe-C (2); Fe-Zn (3) trong không khí ẩm
Trong Thí nghiệm 1, thanh kẽm và thanh đồng được nối với nhau bằng dây dẫn cùng nhúng trong dung dịch chất điện li tạo thành một cặp pin điện hóa. Quá trình xảy ra tại anot của pin điện này là
A. Z n → Z n 2 + + 2 e
B. C u → C u 2 + + 2 e
C. 2 H + + 2 e → H 2
D. C u 2 + + 2 e → C u