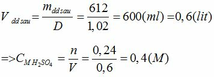Khử 64 g CuO bằng khí CO ở nhiệt độ cao biết hiệu xuất phản ứng đạt 80%.
a, Tính khối lượng Cu tạo thành?
b, Tính khối lượng chất rắn tạo thành sau phản ứng?
Khử hoàn toàn 80 gam hỗn hợp X(gồm CuO và Fe2O3 )bằng khí H2 a. Tính khối lượng mỗi chất trong X biết số mol CuO bằng ½ số mol Fe2O3. a. Tính thể tích H2 cần dùng (đktc) b. Tính khối lượng chất rắn tạo thành sau phản ứng?
\(n_{CuO}=2a\left(mol\right)\Rightarrow n_{Fe_2O_3}=a\left(mol\right)\)
\(m_X=80\cdot2a+160a=80\left(g\right)\)
\(\Rightarrow a=0.25\left(mol\right)\)
\(CuO+H_2\underrightarrow{^{^{t^0}}}Cu+H_2O\)
\(Fe_2O_3+3H_2\underrightarrow{^{^{t^0}}}2Fe+3H_2O\)
\(n_{H_2}=0.5+0.25\cdot3=1.25\left(mol\right)\)
\(V_{H_2}=1.25\cdot22.4=28\left(l\right)\)
\(m_{cr}=0.5\cdot64+0.5\cdot56=60\left(g\right)\)
dẫn khí hidro đi qua ống thủy tinh chứa 16 g bột CuO nung đến 400 độ C
a Tính khối lượng H2O tạo thành nếu lượng CuO phản ứng chiếm 80% lượng ban đầu
b Tính khối lượng chất rắn sau phản ứng Nếu đã dùng 3,718 l H2 ở điều kiện chuẩn và phản ứng xảy ra hoàn toàn
c Tính H% theo CuO nếu khối lượng chất rắn thu được sau phản ứng nặng 13,28 g
cop tên ng ta nè
a) CuO+H2−to→Cu+H2OCuO+H2−to→Cu+H2O
0,21>0,151⇒0,21>0,151⇒Sau phản ứng CuO dư
Chất rắn sau phản ứng là Cu, CuO dư
mcr=0,15.64+(0,2−0,15).80=13,6(g)mcr=0,15.64+(0,2−0,15).80=13,6(g)
c) Gọi x là số mol CuO phản ứng
mcr=(0,2−x).80+64x=13,28mcr=(0,2−x).80+64x=13,28
=> x=0,17 (mol)
B5: Cho 16 (g) Fe2O3 bị khử bởi khí H2. Sau phản ứng thu được là Fe và H2O. Tính khối lượng Fe, khối lượng H2O. Biết H=80%.
B 6: Dùng khí CO để khử CuO ở to cao . Sau phản ứng thu được 19,2 (g) Cu . Tính khối lượng CuO. Tính V CO đã dùng ở đktc Biết H = 85%.
B7: Dùng khí CO để khử ZnO ở to cao . Sau phản ứng thu được 26 (g) Zn. Tính khối lượng ZnO. V CO ở đktc Biết H = 75%.
câu 1:cho 5,4 gam Al phản ứng hoàn tòn với dung dịch H2So4 loãng
a) tính VH2(dktc) thu đc sau phản ứng
b) dùng khí h2 thu đc ở trên khử hoàn toàn CuO ở nhiệt độ cao tính khối lượng Cu thu đc sau phản ứng(hiệu suất của p/u đạt 80%)
câu 2:cho các chất có cthh:KOH,CuCl2,Al2O3,ZnSO4,CuO,Zn(OH)2,H3PO4,N2O5,KHSO4,H2CO3.Hãy phân loại và gọi tên các chất
\(C1\\ n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\\ 2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ n_{H_2}=\dfrac{3}{2}.n_{Al}=\dfrac{3}{2}.0,2=0,3\left(mol\right)\\ a,V_{H_2\left(đktc\right)}=0,3.22,4=6,72\left(l\right)\\ b,H_2+CuO\rightarrow\left(t^o\right)Cu+H_2O\\ n_{Cu\left(LT\right)}=n_{H_2}=0,3\left(mol\right)\\ n_{Cu\left(TT\right)}=n_{Cu\left(LT\right)}.H=0,3.80\%=0,24\left(mol\right)\\ m_{Cu\left(TT\right)}=0,24.80=19,2\left(g\right)\)
- Oxit:
+ Oxit bazo: Al2O3 (Nhôm oxit), CuO (Đồng (II) oxit)
+ Oxit axit: N2O5 (dinito pentaoxit)
- Axit:
H2CO3 (Axit cacbonic), H3PO4 (axit photphoric)
- Bazo:
KOH (Kali hidroxit), Zn(OH)2 (Kẽm hidroxit)
- Muối:
KHSO4 (Kali hidrosunfat), CuCl2 (Đồng (II) clorua), ZnSO4 (Kẽm sunfat)
Bài 5: Dẫn khí H2 đi qua ống thủy tinh chưa 16 gam bột CuO màu đen nung đến 4000C .
a) Tính khối lượng nước tạo thành nếu lượng CuO phản ứng chiếm 80% lượng ban đầu.
b) Tính khối lượng chất rắn sau phản ứng nếu đã dung 3,36 lit H2 ở đktc và phản ứng xảy ra hoàn toàn.
c) Tính hiệu suất phản ứng theo CuO nếu khối lượng chất rắn thu được sau phản ứng nặng 13,28 gam
a) \(CuO+H_2-^{t^o}\rightarrow Cu+H_2O\)
\(n_{CuO\left(bđ\right)}=\dfrac{16}{80}=0,2\left(mol\right)\)
\(\Rightarrow n_{CuO\left(pứ\right)}=0,2.80\%=0,16\left(mol\right)\)
\(n_{H_2O}=n_{CuO}=0,16\left(mol\right)\)
=> \(m_{H_2O}=0,16.18=2,88\left(g\right)\)
b) \(n_{H_2}=0,15\left(mol\right)\)
Lập tỉ lệ : \(\dfrac{0,2}{1}>\dfrac{0,15}{1}\Rightarrow\)Sau phản ứng CuO dư
Chất rắn sau phản ứng là Cu, CuO dư
\(m_{cr}=0,15.64+\left(0,2-0,15\right).80=13,6\left(g\right)\)
c) Gọi x là số mol CuO phản ứng
\(m_{cr}=\left(0,2-x\right).80+64x=13,28\)
=> x=0,17 (mol)
\(H=\dfrac{0,17}{0,2}.100=85\%\)
Bài 5: Dẫn khí H2 đi qua ống thủy tinh chưa 16 gam bột CuO màu đen nung đến 4000C .
a) Tính khối lượng nước tạo thành nếu lượng CuO phản ứng chiếm 80% lượng ban đầu.
b) Tính khối lượng chất rắn sau phản ứng nếu đã dung 3,36 lit H2 ở đktc và phản ứng xảy ra hoàn toàn.
c) Tính hiệu suất phản ứng theo CuO nếu khối lượng chất rắn thu được sau phản ứng nặng 13,28 gam
Khử hoàn toàn 16g bột oxit sắt bằng CO ở nhiệt độ cao. Sau phản ứng kết thúc thấy khối lượng chất rắn giảm 4,8g.
a) Xác định CTHH của oxit sắt trên?
b) Dẫn chất khí thu được qua dung dịch Ca(OH)2 dư. Tính khối lượng kết tủa tạo thành
c) Tính thể tích CO cần dùng cho phản ứng trên biết rằng phải dùng CO dư 10% so với lí thuyết và thể tích các chất khí đo ở ĐKTC
a. áp dụng định luật bảo toàn nguyên tố
=> 4,8 g là khối lượng O trong oxit sắt
=> nO = 0,3 ; nFe = 0,2
CT oxit sắt là Fe2O3
b. Fe2O3 + 3CO ---> 2Fe + 3CO2
nCO = 0,3 mol
dùng dư 10% => nCO = 0,3 x 110% = 0,33 mol
CÂU C BN TỰ LM NHA, LƯỜI WÁ![]()
Gọi công thức oxit sắt:Fex0y.
Fex0y+yCO=>xFe+yC02
0.2/x------------>0.2(mol)
_Sau pư khối lượng chất rắn giảm 4.8 g so với ban đầu:
=>mFe=16-4.8=11.2(g)
=>nFe=11.2/56=0.2(mol)
=>n(Fex0y)=0.2/x(mol)
Mà nFex0y=16/(56x+16y) (mol)
=>16x=0.2(56x+16y)
<=>4.8x=3.2y
<=>x/y=2/3
Vậy công thức oxit sắt là Fe203.
_Khí sinh ra là C02 cho tác dụng với dd NaOH:
nC02=0.2*3=0.6(mol)
_Khối lượng dd tăng cũng chính là khối lượng C02 tham gia:
C02+2NaOH=>Na2S03+H20
0.6--->1.2-------->0.6(mol)
=>mC02=0.6*44=26.4(g)
khử 16g sắt lll Oxit=khí Hiđrô :a) viết pt b) Tính khối lượng sắt thu được c) tinh the tích khí hiđrô ở (dktc)
Ở nhiệt độ cao, CuO phản ứng với H2 tạo thành Cu và H2O. Tính khối lượng Cu thu được khi sử dụng 16 gam CuO.
Cho Cu=64; O=16; H=1
\(n_{CuO}=0,2\left(mol\right)\)
\(CuO+H_2\xrightarrow[]{t^\circ}Cu+H_2O \)
0,2 → 0,2
\(\Rightarrow m_{Cu}=0,2\cdot64=12,8\left(g\right)\)
\(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
0,1 0,1
\(n_{CuO}=\dfrac{16}{160}=0,1\left(mol\right)\)
\(m_{Cu}=0,1.64=6,4\left(g\right)\)
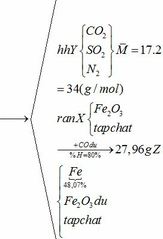
Hỗn hợp chất rắn A gồm FeCO3, FeS2 và tạp chất trơ. Hỗn hợp khí B gồm 20% oxi và 80% nitơ về thể tích. Cho hỗn hợp A vào bình kín dung tích 10 lít ( không đổi) chứa lượng hỗn hợp B vừa đủ. Nung nóng bình cho các phản ứng xảy ra hoàn toàn, các phản ứng cùng tạo ra một oxit sắt, oxit này phản ứng với dung dịch HNO3 dư không tạo ra khí. Sau phản ứng, đưa nhiệt độ bình về 136,50C, trong bình còn lại chất rắn X và hỗn hợp khí Y. Tỉ khối của Y so với H2 bằng 17 và áp suất trong bình là P atm. Cho dòng khí CO dư đi qua X đun nóng, biết rằng chỉ xảy ra phản ứng khử oxit sắt thành kim loại và đạt hiệu suất 80%.Sau phản ứng thu được 27,96 gam chất rắn Z, trong đó kim loại chiếm 48,07% khối lượng.
(a) Tính giá trị của P ( coi thể tích chất rắn X là rất nhỏ) và thành phần % khối lượng tạp chất trong A.
(b) Cho Y phản ứng với oxi ( dư) có V2O5 ( xúc tác) ở 4500C, hấp thụ sản phẩm vào 592,8 gam nước, được dung dịch C ( D = 1,02 gam/ml). Tính nồng độ mol của dung dịch C. Giả thiết hiệu suất của quá trình là 100%.
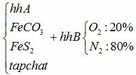
a) Gọi số mol của FeCO3: x (mol) ;
số mol của FeS2: y (mol)
4FeCO3 + O2 → Fe2O3 + 4CO2↑
x → 0,25x → x (mol)
4FeS2 +11O2 → 2Fe2O3 + 8SO2↑
y → 2,75y → 2y (mol)
∑ nO2 = 0,25x + 2,75y (mol)
Cùng điều kiện về nhiệt độ và áp suất nên tỉ lệ về thể tích = tỉ lệ về số mol
=> nN2 = 4nO2 = 4(0,25x + 2,75y)
=> nN2 = x + 11y (mol)
Vậy hỗn hợp Y gồm:
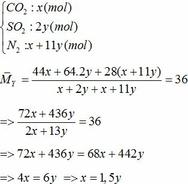
Khối lượng Fe có trong Z là:
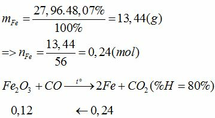
Vì H = 80% => nFe2O3 (trong X) = 0,12. 100% : 80% = 0,15 (mol)
nFe2O3 dư (trong Z) = 0,15 – 0,12 = 0,03 (mol)
Khối lượng tạp chất trong Z = 27,96 – mFe – mFe2O3 dư = 27,96 – 0,24.56 – 0,03.160 = 9,72 (g)
Bảo toàn nguyên tố Fe => nFeCO3 + nFeS2 = 2nFe2O3(trong X)
=> x + y = 0,3 (2)
Từ (1) và (2) => x = 0,18 và y = 0,12 (mol)
Áp dụng công thức PV = nRT ( với n = nCO2 + nSO2 + nN2 = 0,18 + 2. 0,12 + 0,18 +11.0,12 = 1,92)
=> P.10 = 1,92.0,082. (136,5 +273)
=> P = 6,447 ( atm) ≈ 6,5 (atm)
Ta có: mA = mFeCO3 + mFeS2 + mtạp chất = 0,18.116 + 0,12.120 + 9,72 = 45 (g)
![]()
b) hỗn hợp Y gồm:
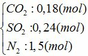
Cho hỗn hợp Y qua O2 ( xúc tác V2O5 ) có phản ứng sau:
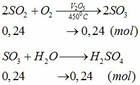
Khối lượng dd sau: mdd sau = mSO3 + mH2O = 0,24. 80 + 592,8 = 612 (g)