Phương trình nhiệt hóa học cho biết thông tin gì về phản ứng hóa học.

Những câu hỏi liên quan
Viết phương trình hóa học biểu diễn phản ứng của hiđro với các chất: O2, Fe2O3, Fe3O4, PbO ở nhiệt độ thích hợp. Ghi rõ điều kiện phản ứng. Giải thích và cho biết mỗi phản ứng trên thuộc loại phản ứng gì?
Phương trình hóa học biểu diễn các phản ứng:
2H2 + O2 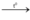 2H2O (pứ hóa hợp + oxi hóa khử)
2H2O (pứ hóa hợp + oxi hóa khử)
4H2 + Fe3O4 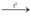 4H2O + 3Fe (pứ thế + oxi hóa khử)
4H2O + 3Fe (pứ thế + oxi hóa khử)
3H2 + Fe2O3 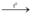 3H2O + 3Fe (pứ thế + oxi hóa khử)
3H2O + 3Fe (pứ thế + oxi hóa khử)
H2 + PbO 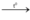 H2O + Pb (pứ thế + oxi hóa khử)
H2O + Pb (pứ thế + oxi hóa khử)
Các phản ứng trên đều là phản ứng oxi – hóa khử vì đều có đồng thời sự khử và sự oxi hóa
Đúng 0
Bình luận (0)
Viết phương trình hóa học biểu diễn phản ứng của hiđro với các chất: O2, Fe2O3, Fe3O4, PbO ở nhiệt độ thích hợp. Ghi rõ điều kiện phản ứng. Giải thích và cho biết mỗi phản ứng trên thuộc loại phản ứng gì?
\(2H_2+O_2\xrightarrow[]{t^o}2H_2O\\ Fe_2O_3+3H_2\xrightarrow[]{t^o}2Fe+3H_2O\\ Fe_3O_4+4H_2\xrightarrow[]{t^o}3Fe+4H_2O\\ PbO+H_2\xrightarrow[]{t^o}Pb+H_2O\)
Đúng 2
Bình luận (0)
Viết phương trình hóa học biểu diễn phản ứng của hiđro với các chất: O2, Fe2O3, Fe3O4, PbO ở nhiệt độ thích hợp. Ghi rõ điều kiện phản ứng. Giải thích và cho biết mỗi phản ứng trên thuộc loại phản ứng gì?
2H2 + O2 -to-> H2O (1)
Fe2O3 + H2 -.to-> 2Fe + 3CO2 (2)
Fe3O4 + 4H2-to-> 3Fe +4H2O (3)
PbO + H2 -to-> Pb + H2O (4)
Các phản ứng trên đều là phản ứng oxi hóa khử
Trong đó, H2 là chất khử vì là chất chiếm oxi của chất khác và O2, Fe3O4, Fe2O3, PbO đều là chất oxi hóa vì là chất nhường oxi cho H2 (phản ứng (1) còn được gọi là phản ứng hóa hợp)
Đúng 2
Bình luận (1)
a) Phương trình hóa học biểu diễn gì, gồm công thức hóa học của những chất nào?
b) Sơ đồ của phản ứng khác với phương trình hóa học của phản ứng ở điểm nào?
c) Nêu ý nghĩa của phương trình hóa học?
a) Phương trình hóa học biểu diễn ngắn gọn phản ứng hóa học, gồm công thức hóa học của chất phản ứng và sản phẩm phản ứng.
b) Sơ đồ của phản ứng khác với phương trình hóa học là chưa có hệ số thích hợp, tức là chưa cân bằng nguyên tử. Tuy nhiên có một số trường hợp thì sơ đồ cũng là phương trình hóa học.
c) Phương trình hóa học cho biết tỉ lệ về số nguyên tử, số phân tử giữa các chất trong phản ứng cũng như từng cặp chất trong phản ứng.
Đúng 0
Bình luận (0)
Cân bằng phương trình hóa học của phản ứng oxi hóa khử sau bằng phương pháp thăng bằng electron và cho biết chất khử, chất oxi hóa trong phản ứng gì: Zn + H2SO4 -> ZnSO4 + S + H2O
Ta có:
\(Zn^0-2e\rightarrow Zn^{+2}|3\)
\(S^{+6}+6e\rightarrow S^0|1\)
Vậy ta có PTHH:
\(3Zn+4H_2SO_4--->3ZnSO_4+S+4H_2O\)
Đúng 1
Bình luận (0)
\(3Zn+4H_2SO_4->3ZnSO_4+S+4H_2O\)
Chất khử: Zn
Chất oxh: H2SO4
| Zn0-2e-->Zn+2 | x3 |
| S+6+6e --> S0 | x1 |
Đúng 0
Bình luận (0)
Phản ứng hóa học xảy ra khi cồn cháy (đèn cồn trong phòng thí nghiệm) làRượu etylic
C
2
H
5
O
H
+ oxi
→
cacbonic
C
O
2
+ nước1) Hãy lập phương trình hóa học của phản ứng.2) Cho biết tỉ lệ số phân tử của các chất trong phản ứng hóa học.3) Tính tỉ lệ về khối lượng giữ...
Đọc tiếp
Phản ứng hóa học xảy ra khi cồn cháy (đèn cồn trong phòng thí nghiệm) là
Rượu etylic C 2 H 5 O H + oxi → cacbonic C O 2 + nước
1) Hãy lập phương trình hóa học của phản ứng.
2) Cho biết tỉ lệ số phân tử của các chất trong phản ứng hóa học.
3) Tính tỉ lệ về khối lượng giữa các chất trong phản ứng hóa học.
Khử 0,15 mol Fe2O3 ở nhiệt độ cao bằng những chất khác nhau là khí CO, khí H2, bột Ala. Viết Phương trình phản ứng hóa học xảy rab. Các phản ứng hóa học trên thuộc loại phản ứng nào? Cho biết vai trò của mỗi chất tham gia ở cácphản ứng trênc. Tính thể tích (đktc) của chất khử thể khí và khối lượng của chất khử thể rắn đã dùng.d. Khối lượng sắt thu được sau các phản ứng trên có khác nhau không? Giải thích
Đọc tiếp
Khử 0,15 mol Fe2O3 ở nhiệt độ cao bằng những chất khác nhau là khí CO, khí H2, bột Al
a. Viết Phương trình phản ứng hóa học xảy ra
b. Các phản ứng hóa học trên thuộc loại phản ứng nào? Cho biết vai trò của mỗi chất tham gia ở các
phản ứng trên
c. Tính thể tích (đktc) của chất khử thể khí và khối lượng của chất khử thể rắn đã dùng.
d. Khối lượng sắt thu được sau các phản ứng trên có khác nhau không? Giải thích
a)
$Fe_2O_3 + 3CO \xrightarrow{t^o} 2Fe + 3CO_2$
$Fe_2O_3 + 3H_2 \xrightarrow{t^o} 2Fe + 3H_2O$
$Fe_2O_3 + 2Al \xrightarrow{t^o} 2Fe + Al_2O_3$
b) Phản ứng oxi hóa - khử
Chất khử : $CO,H_2,Al$
Chấy oxi hóa : $Fe_2O_3$
c)
$n_{CO} = n_{H_2} = 3n_{Fe_2O_3} = 0,45(mol)$
$V_{CO} = V_{H_2} = 0,45.22,4 = 10,08(lít)$
$n_{Al} = 2n_{Fe_2O_3} = 0,3(mol)$
$m_{Al} = 0,3.27 = 8,1(gam)$
d)
Khối lượng sắt thu được ở phản ứng trên đều như nhau
(Do đều sinh ra Fe với tỉ lệ mol $Fe_2O_3$ : $Fe$ là 1 : 2)
Đúng 2
Bình luận (0)
Bài 2: Nhiệt phân 18,375 gam KClO3 trong phòng thí nghiệm, thu được KCl và khí oxi (O2). a. Viết phương trình hóa học của phản ứng trên? Cho biết phản ứng trên thuộc loại phản ứng gì? Vì sao? b. Tính thể tích khí O2 thu được ( ở đktc). c. Tính thể tích của không khí để chứa lượng oxi trên?Biết thể tích oxi bằng 1/5 lần thể tích không khí ( Biết: K 39; Cl 35,5; O 16;).
Đọc tiếp
Bài 2: Nhiệt phân 18,375 gam KClO3 trong phòng thí nghiệm, thu được KCl và khí oxi (O2).
a. Viết phương trình hóa học của phản ứng trên? Cho biết phản ứng trên thuộc loại phản ứng gì? Vì sao?
b. Tính thể tích khí O2 thu được ( ở đktc).
c. Tính thể tích của không khí để chứa lượng oxi trên?Biết thể tích oxi bằng 1/5 lần thể tích không khí
( Biết: K = 39; Cl = 35,5; O = 16;).
a. \(n_{KClO_3}=\dfrac{18.375}{122,5}=0,15\left(mol\right)\)
PTHH : 2KClO3 ----to---> 2KCl + 3O2
0,15 0,225
Phản ứng trên là phản ứng phân hủy . Vì phản ứng phân hủy là một phản ứng hóa học mà trong đó một chất tham gia có thể tạo thành hai hay nhiều chất mới.
b. \(V_{O_2}=0,225.22,4=5,04\left(l\right)\)
c. \(V_{kk}=5,04.5=25,2\left(l\right)\)
Đúng 2
Bình luận (0)
Bài 1:Nhiệt phân 118,5 gam KMnO4 trong phòng thí nghiệm, thu được muối K2MnO4 ,MnO2 và khí oxi (O2). a. Viết phương trình hóa học của phản ứng trên? Cho biết phản ứng trên thuộc loại phản ứng gì? Vì sao? b. Tính thể tích khí O2 thu được ( ở đktc)? c. Tính thể tích của không khí để chứa lượng oxi trên? Biết thể tích oxi bằng 1/5 lần thể tích không khí ( Biết: K 39; O 16; Mn 55, S 32)
Đọc tiếp
Bài 1:Nhiệt phân 118,5 gam KMnO4 trong phòng thí nghiệm, thu được muối K2MnO4 ,MnO2 và khí oxi (O2).
a. Viết phương trình hóa học của phản ứng trên? Cho biết phản ứng trên thuộc loại phản ứng gì? Vì sao?
b. Tính thể tích khí O2 thu được ( ở đktc)?
c. Tính thể tích của không khí để chứa lượng oxi trên? Biết thể tích oxi bằng 1/5 lần thể tích không khí
( Biết: K = 39; O = 16; Mn = 55, S = 32)
a. \(n_{KMnO_4}=\dfrac{118.5}{158}=0,75\left(mol\right)\)
PTHH : 2KMnO4 -----to----> K2MnO4 + MnO2 + O2
0,75 0,375
Phản ứng trên là phản ứng phân hủy . Vì phản ứng phân hủy là một phản ứng hóa học mà trong đó một chất tham gia có thể tạo thành hai hay nhiều chất mới.
b. \(V_{O_2}=0,375.22,4=8,4\left(l\right)\)
c. \(V_{kk}=8,4.5=42\left(l\right)\)
Đúng 2
Bình luận (0)
a) 2KMn04 --> K2MnO4 + MnO2 + O2↑
PƯ này thuộc loại PƯ phân hủy
b) Có nKMnO4 = \(\dfrac{118.5}{39+55+16.4}\)=\(\dfrac{3}{4}\)=0,75
=> nO2 = 0,75x \(\dfrac{1}{2}\)=0,375
=> V của O2 là: 0,375 x 22,4=8,4(l)
c) Thể tích của ko khí là: 1/5 x 8,4=1,68(l)
Đúng 0
Bình luận (1)
Bài 1:Nhiệt phân 118,5 gam KMnO4 trong phòng thí nghiệm, thu được muối K2MnO4 ,MnO2 và khí oxi (O2). a. Viết phương trình hóa học của phản ứng trên? Cho biết phản ứng trên thuộc loại phản ứng gì? Vì sao?
b. Tính thể tích khí O2 thu được ( ở đktc)? c. Tính thể tích của không khí để chứa lượng oxi trên? Biết thể tích oxi bằng 1/5 lần thể tích không khí ( Biết: K = 39; O = 16; Mn = 55, S = 32)
\(n_{KMnO_4}=\dfrac{118,5}{158}=0,75\left(mol\right)\\
pthh:2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
0,75 0,375
=> \(V_{O_2}=0,375.22,4=8,4\left(l\right)\\
V_{kk}=8,4.5=42\left(l\right)\)
Đúng 2
Bình luận (1)






















