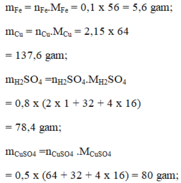A)Tính khối lượng mol của H2SO4
B)Tính khối lượng mol của H2SO4 khi đã có 2,5 mol H2SO4

Những câu hỏi liên quan
Bài 3. Tính khối lượng của những lượng chất sau:
a, 0,5 mol H2SO4 ; 0,2 mol NaOH ; 0,1 mol Ag.
b*, Tính khối lượng của 15.1023 phân tử SO2
a.
\(m_{H_2SO_4}=0.5\cdot98=49\left(g\right)\)
\(m_{NaOH}=0.2\cdot40=8\left(g\right)\)
\(m_{Ag}=0.1\cdot108=10.8\left(g\right)\)
b.
\(n_{SO_2}=\dfrac{15\cdot10^{23}}{6\cdot10^{23}}=2.5\left(mol\right)\)
\(m_{SO_2}=2.5\cdot64=160\left(g\right)\)
Đúng 1
Bình luận (0)
Bài 7: a) Tính khối lượng của 0,5 mol sắt.b) Cho biết khối lượng của 6.1023 phân tử của mỗi chất sau: CO2; Al2O3; C6H12O6; H2SO4.Bài 8: a) Trong 112 gam canxi có bao nhiêu mol canxi?b) Tính khối lượng của 0,5 mol axit clohidric (HCl).c) Trong 49 gam axit sunfuric có bao nhiêu mol H2SO4.
Đọc tiếp
Bài 7: a) Tính khối lượng của 0,5 mol sắt.
b) Cho biết khối lượng của 6.1023 phân tử của mỗi chất sau: CO2; Al2O3; C6H12O6; H2SO4.
Bài 8: a) Trong 112 gam canxi có bao nhiêu mol canxi?
b) Tính khối lượng của 0,5 mol axit clohidric (HCl).
c) Trong 49 gam axit sunfuric có bao nhiêu mol H2SO4.
Bài 7:
\(a.m_{Fe}=0,5.56=28\left(g\right)\\ b.n_{p.tử}=\dfrac{6.10^{23}}{6.10^{23}}=1\left(mol\right)\\ m_{CO_2}=44.1=44\left(g\right)\\ m_{Al_2O_3}=1.102=102\left(g\right)\\ m_{C_6H_{12}O_6}=180.1=180\left(g\right)\\ m_{H_2SO_4}=98.1=98\left(g\right)\)
Bài 8:
\(a.n_{Ca}=\dfrac{112}{40}=2,8\left(mol\right)\\ b.m_{HCl}=36,5.0,5=18,25\left(g\right)\\ c.n_{H_2SO_4}=\dfrac{49}{98}=0,5\left(mol\right)\)
Đúng 3
Bình luận (4)
Hãy tính khối lượng của những lượng chất sau: 0,1 mol Fe; 2,15 mol Cu; 0,8 mol H 2 S O 4 ; 0,5 mol C u S O 4 .
Cho một khối lượng magie dư vào 200ml dd H2SO4. Sau phản ứng thu được 3,36 lít khí (đktc).
a) Tính khối lượng magie tham gia phản ứng.
b) Tính nồng độ mol của dung dịch H2SO4 đã dùng.
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\uparrow\\ n_{Mg}=n_{H_2SO_4}=n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ a,m_{Mg}=0,15.24=3,6\left(g\right)\\ b,C_{MddH_2SO_4}=\dfrac{0,15}{0,2}=0,75\left(M\right)\)
Đúng 0
Bình luận (0)
Hãy tính khối lượng của 2 mol H2S 0,25 mol H2SO4 0,5 mol CuO
\(m_{H_2S}=2.34=68\left(g\right)\)
\(m_{H_2SO_4}=0,25.98=24,5\left(g\right)\)
\(m_{CuO}=0,5.80=40\left(g\right)\)
Đúng 2
Bình luận (0)
áp dụng công thức : m = n.M
Ta có : \(m_{H2S}\) = 2.34 = 68 (g)
\(m_{H2SO4}\) = 0,25 .98= 24,5 (g)
\(m_{CuO}\) = 0,5 . 80 = 40 (g)
Đúng 1
Bình luận (0)
Cho một mẩu sắt tác dụng vủa đủ 200ml dung dịch axit H2SO4, sau khi phản ứng xảy ra hoàn toàn thu được 6,72 lít khí H2 ở đktc.a/ Tính khối lượng sắt đã dùng.b/ Tính nồng độ mol của dung dịch H2SO4 đã dùng.c/ Tính nồng độ mol của dung dịch muối thu được. Biết thể tích dung dịch thay đổi không đáng kể.
Đọc tiếp
Cho một mẩu sắt tác dụng vủa đủ 200ml dung dịch axit H2SO4, sau khi phản ứng xảy ra hoàn toàn thu được 6,72 lít khí H2 ở đktc.
a/ Tính khối lượng sắt đã dùng.
b/ Tính nồng độ mol của dung dịch H2SO4 đã dùng.
c/ Tính nồng độ mol của dung dịch muối thu được. Biết thể tích dung dịch thay đổi không đáng kể.
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
0,3 0,3 0,3 0,3
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(m_{Fe}=0,3.56=16,8\left(g\right)\)
\(C_{M_{H_2SO_4}}=\dfrac{n}{V}=\dfrac{0,3}{0,2}=1,5M\)
\(C_{M_{FeSO_4}}=\dfrac{n}{V}=\dfrac{0,3}{0,2}=1,5M\)
Đúng 2
Bình luận (0)
PTHH: Fe + H₂SO₄ --> FeSO₄ + H₂
200ml = 0,2 lít.
a) Số mol H₂: nH₂ = 6,72 ÷ 22,4 = 0,3 mol
Theo PTHH => Số mol Fe: nFe = 0,3 mol
=> Khối lượng Fe: mFe = 16,8g
b) Số mol H₂SO₄: nH₂SO₄ = 0,3 mol
Nồng độ mol dd: CM = 0,3 ÷ 0,2 = 1,5M
Đúng 0
Bình luận (0)
1.Tính khối lượng của:
b. 0,6 mol Cu
c. 0,8 mol (NH4)2 SO4
a) \(m_{Cu}=0,6.64=38,4\left(g\right)\)
b) \(m_{\left(NH4\right)2SO4}=0,8.132=105,6\left(g\right)\)
Đúng 0
Bình luận (0)
Câu 1 : Tính khối lượng của :
a, 0,5 mol H2SO4
b, 2 mol NaOH
c, 0,2 mol Al2(SO4)3
Tính khối lượng MOL của: 0,5 MOL H2SO4
Giải:m 0,5mol H2SO4=n.M=0,5.98=49(g)
Mik trình bày thêm 0,5 mol H2SO4 vào có sai ko ạ.Tại đây ko đăng ảnh dc nên mn cố hình dung nha
Xem chi tiết
thay vì :'m 0,5 mol H2SO4 =' thì bn nên đánh là 'khối lượng của 0,5 mol H2SO4 là' thì sẽ hay hơn
Đúng 0
Bình luận (0)