Đốt cháy hoàn toàn a gam chất hữu cơ A cần phải dùng 13,44 lít khí Oxi ở (đktc)thu được 26,4 g CO2 và 10,8 g H2 a)Xác định công thức đơn giản nhất của A b)Xác định công thức phân tử của A biết 170g/mol < MA < 190g/mol

Những câu hỏi liên quan
Đốt cháy hoàn toàn m gam chất hữu cơ A cần phải dùng 19,2 gam oxi, thu được 26,4 gam CO 2 và 10,8 gam H 2 O . Xác định công thức đơn giản nhất của A.
Sơ đồ phản ứng cháy của A :
A + O 2 → t ° CO 2 + H 2 O
Ta có: m A + m O 2 = m CO 2 + m H 2 O
→ m A = m CO 2 + m H 2 O - m O 2 = 26,4 + 10,8 - 19,2 = 18g
Khối lượng C trong 18 gam A là : 26,4/44 x 12 = 7,2g
Khối lượng H trong 18 gam A là : 10,8/18 x 2 = 1,2g
Khối lượng O trong 18 gam A lấ 18 - 7,2 - 1,2 = 9,6 (gam).
Gọi công thức hoá học của A là C x H y O z
Ta có quan hệ
12x : y : 16z = 7,2 : 1,2 : 9,6
x : y : z = 7,2/12 : 1,2/1 : 9,6/16 = 0,6 : 1,2 : 0,6 = 1 : 2 : 1
Chọn x = 1 → công thức đơn giản nhất của A là CH 2 O
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn m gam chất hữu cơ A cần phải dùng 19,2 gam oxi, thu được 26,4 gam CO 2 và 10,8 gam H 2 O . Xác định công thức phân tử của A biết 170 gam/mol > d > 190 gam/mol.
M A = 30n → 170 < 30n < 190
→ n = 6.
Công thức phân tử của A là C 6 H 12 O 6
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn 5,7 gam chất hữu cơ X thu được 6,72 lít khí CO2 (đktc) và 4,5 gam H2O. a. Xác định công thức đơn giản nhất của X. b. Xác định công thức phân tử của X, biết tỉ khối hơi của X so với H2 là 57.
nCO2= 0,3(mol) -> nC=0,3(mol)
nH2O =0,25(mol) -> nH=0,5(mol)
mC+mH=0,3.12+0,5.1=4,1(g) < 5,7(g)
=>mO=5,7-4,1=1,6(g) -> nO=0,1(mol)
Gọi CTTQ X: CxHyOz (x,y,z: nguyên, dương)
Ta có: x:y:z= 0,3:0,5:1= 3:5:1
=> CT ĐG nhất X: C3H5O.
b) M(X)=57.2=114(g/mol)
Mà: M(X)=M(C3H5O)a= 57a
<=>114=57a
<=>a=2
=>CTPT X : C6H10O2
Đúng 1
Bình luận (0)
Để đốt cháy hoàn toàn một lượng chất hữu cơ A phải dùng vừa hết 3,08 lít
O
2
. Sản phẩm thu được chỉ gồm có 1,80 g
H
2
O
và 2,24 lít
C
O
2
. Các thể tích khí đo ở đktc.1. Xác định công thức đơn giản nhất của A.2. Xác định công thức phân tử của A, biết rằng tỉ khối hơi của A đối với oxi là 2,25.3. Xác định công thức cấu tạo có thể có của chất A, ghi...
Đọc tiếp
Để đốt cháy hoàn toàn một lượng chất hữu cơ A phải dùng vừa hết 3,08 lít O 2 . Sản phẩm thu được chỉ gồm có 1,80 g H 2 O và 2,24 lít C O 2 . Các thể tích khí đo ở đktc.
1. Xác định công thức đơn giản nhất của A.
2. Xác định công thức phân tử của A, biết rằng tỉ khối hơi của A đối với oxi là 2,25.
3. Xác định công thức cấu tạo có thể có của chất A, ghi tên tương ứng, biết rằng A là hợp chất cacbonyl.
1. Theo định luật bảo toàn khối lượng:
m A = m C O 2 + m H 2 O − m O 2
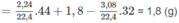
Khối lượng C trong 1,8 g A là: 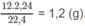
Khối lượng H trong 1,8 g A là: 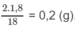
Khối lượng O trong 1,8 g A là : 1,8 - 1,2 - 0,2 = 0,4 (g).
Công thức chất A có dạng C x H y O z :
x : y : z = 0,1 : 0,2 : 0,025 = 4 : 8 : 1
CTĐGN là C 4 H 8 O
2. M A = 2,25.32 = 72 (g/mol)
⇒ CTPT trùng với CTĐGN: C 4 H 8 O .
3. Các hợp chất cacbonyl C 4 H 8 O :
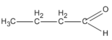 (butanal)
(butanal)
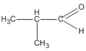 (2-metylpropanal)
(2-metylpropanal)
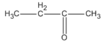 (butan-2-ol)
(butan-2-ol)
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn 2,9 gam chất hữu cơ X thu được 3,36 lít khí CO2 (đktc)
và 2,7 gam H2O.
a. Xác định công thức đơn giản nhất của X.
b. Xác định công thức phân tử của X, biết tỉ khối hơi của X so với H2 là 29.
(O = 16; C = 12; H = 1)
nCO2=0,15(mol) -> nC= 0,15(mol)
nH2O=0,15(mol) -> nH= 0,3(mol)
Giả sử X có 3 nguyên tố tạo thành: C,H và O.
mX=mC+mH+mO= 0,15.12+ 0,3.1+mO
<=> 2,9=2,1+mO
<=>mO=0,8(g) => nO=0,05(mol)
Gọi CTTQ : CxHyOz (x,y,z: nguyên, dương)
x:y:z=nC:nH:nO= 0,15:0,3:0,05=3:6:1
=> CTĐGN X: C3H6O
b) M(X)=29.2=58(g/mol)
Ta có: M(X)= M(C3H6O)a= 58a
=> 58a=58
<=>a=1
=> CTPT X: C3H6O
Đúng 2
Bình luận (0)
Đốt cháy hoàn toàn 4,6 g hợp chất hữu cơ A thu được 5,4 gam H2O và 4,48 lít CO2 ở điều kiện chuẩn xác định công thức đơn giản nhất và công thức phân tử biết a có tỉ khối so với CH4 là 2,875
Xem chi tiết
Ta có: \(\left\{{}\begin{matrix}n_{CO_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\n_{H_2O}=\dfrac{5,4}{18}=0,3\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}n_C=0,2mol\\n_H=0,6mol\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_C=0,2\cdot12=2,4\left(g\right)\\m_H=0,6\cdot1=0,6\left(g\right)\end{matrix}\right.\)
Ta thấy: \(m_C+m_H< m_A\) \(\Rightarrow\) Trong A có Oxi
\(\Rightarrow m_O=1,6\left(g\right)\) \(\Rightarrow n_O=\dfrac{1,6}{16}=0,1\left(mol\right)\)
Xét tỉ lệ: \(C:H:O=0,2:0,6:0,1=2:6:1\)
\(\Rightarrow\) Công thức đơn giản nhất là: C2H6O
\(\Rightarrow\) Công thức phân tử: (C2H6O)n
Mà \(M_A=2,875\cdot16=46\)
\(\Rightarrow n=1\)
Vậy công thức phân tử và công thức đơn giản nhất cần tìm là C2H6O
Đúng 1
Bình luận (0)
nH2=5,4: 18 x 2=0,6
nC= 4,48 : 22,4=0,2
mO=0,6+ 0,2 x12=1,6 ----> nO= 1,6 : 16=0,1
công thức phân tử: CxHyOz là C2H6O
ok nha bạn :))
Đúng 0
Bình luận (0)
\(n_C = n_{CO_2} = \dfrac{4,48}{22,4} = 0,2(mol)\\ n_H = 2n_{H_2O} = 2.\dfrac{5,4}{18} = 0,6(mol)\\ \Rightarrow n_O = \dfrac{m_A - m_C-m_H}{16} = \dfrac{4,6-0,2.12-0,6.1}{16} = 0,1(mol)\)
Ta có :
\(n_A = \dfrac{4,6}{2,875.16} = 0,1(mol)\)
Số nguyên tử C : \(\dfrac{n_C}{n_A} = \dfrac{0,2}{0,1} = 2\)
Số nguyên tử H : \(\dfrac{n_H}{n_A} = \dfrac{0,6}{0,1} = 6\)
Số nguyên tử O : \(\dfrac{n_O}{n_A} = \dfrac{0,1}{0,1} = 1\)
Vậy CTPT cần tìm : \(C_2H_6O\)
Đúng 0
Bình luận (0)
Hai chất hữu cơ A, B có cùng công thức phân tử. Đốt cháy hoàn toàn 7,4 gam hỗn hợp A, B thu được 17,6 gam
CO
2
và 9 gam
H
2
O
. Xác định công thức phân tử của A, B. Biết trong phân tử A, B chứa một nguyên tử oxi.Cho 7,4 gam hỗn hợp A, B tác dụng với Na dư sao cho phản ứng xảy ra hoàn toàn thấy tạo ra 0,672 lít khí
H
2...
Đọc tiếp
Hai chất hữu cơ A, B có cùng công thức phân tử. Đốt cháy hoàn toàn 7,4 gam hỗn hợp A, B thu được 17,6 gam CO 2 và 9 gam H 2 O . Xác định công thức phân tử của A, B. Biết trong phân tử A, B chứa một nguyên tử oxi.
Cho 7,4 gam hỗn hợp A, B tác dụng với Na dư sao cho phản ứng xảy ra hoàn toàn thấy tạo ra 0,672 lít khí H 2 ở đktc. Hãy xác định công thức cấu tạo của A, B.
Gọi công thức phân tử của A, B là C x H y O
Phương trình hoá học:
C x H y O + (x +y/4 -1/2) O 2 → x CO 2 + y/2 H 2 O
n CO 2 = 17,6/44 = 0,4 mol; n H 2 O = 9/18 = 0,5 mol (1)
m C = 0,4.12 = 4,8 gam; m H = 0,5.2 = 1g (2)
Từ (1), (2)
→ x : y : 1 = 4,8/12 : 1/1 : 1,6/16 = 0,4 : 1 : 0,1
Vậy m O = 7,4 - 4,8 - 1,0 = 1,6 (gam)
=> Công thức phân tử của A, B là C 4 H 10 O
Ta có M A , B = 74 (g/mol)
n A , B = 7,4/74 = 0,1 mol
Khi phản ứng với Na có khí bay ra → trong A, B có nhóm OH.
Phương trình hoá học :
C 4 H 9 OH + Na → C 4 H 9 ONa + 1/2 H 2
Vậy số mol có nhóm OH là 2 n H 2 = 2. 0,672/22,4 = 0,06 < n A , B
→ trong A, B có 1 chất không có nhóm OH → Cấu tạo tương ứng là
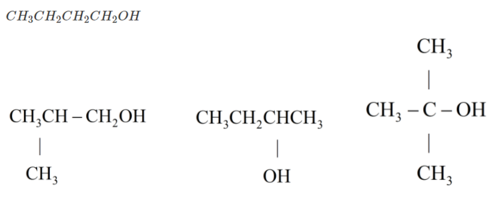
Chất không có nhóm OH :
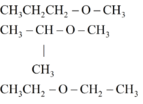
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn 7,2 gam hợp chất hữu cơ X thu được 11,2 lít CO2 (đktc) và 10,8 gam nước. Biết rằng 7,2 gam X có số mol bằng số mol của 3,2 gam khí oxi.
a) Xác định công thức phân tử của X.
b) Viết tất cả các công thức cấu tạo có thể có của X.
Đọc tiếp
Đốt cháy hoàn toàn 7,2 gam hợp chất hữu cơ X thu được 11,2 lít CO2 (đktc) và 10,8 gam nước. Biết rằng 7,2 gam X có số mol bằng số mol của 3,2 gam khí oxi.
a) Xác định công thức phân tử của X.
b) Viết tất cả các công thức cấu tạo có thể có của X.
\(n_C=n_{CO_2}=0,5\left(mol\right);n_H=2.n_{H_2O}=2.\dfrac{10,8}{18}=1,2\left(mol\right)\\ m_C+m_H=0,5.12+1,2.1=7,7,2\\ \Rightarrow X.ko.có.oxi\left(O\right)\\ \Rightarrow CTTQ:C_xH_y\left(x,y:nguyên,dương\right)\\ x:y=n_C:n_H=0,5:1,2=5:12\\a, \Rightarrow x=5;y=12\Rightarrow CTPT.X:C_5H_{12}\\ b,CH_3-CH_2-CH_2-CH_2-CH_3\\ CH_3-CH\left(CH_3\right)-CH_2-CH_3\\ CH_3-C\left(CH_3\right)_2-CH_3\)
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn 1,8 gam hợp chất hữu cơ (A) thu được 1,792 lít CO2
(đktc) và 1,8 gam H2O. Tỉ khối của A so với H2 là 45. Xác định công thức phân tử
và công thức đơn giản nhất của A. (Cho biết C = 12, H = 1; O =16, N= 14)
$n_C = n_{CO_2} = \dfrac{1,792}{22,4} = 0,08(mol)$
$n_H = 2n_{H_2O} = 2.\dfrac{1,8}{18} = 0,2(mol)$
$n_O = \dfrac{1,8 - 0,08.12 - 0,2.1}{16} = 0,04(mol)$
Ta có :
$n_C : n_H : n_O = 0,08 : 0,2 : 0,04 = 2 : 5 : 1$
Vậy CTĐGN là $C_2H_5O$
CTPT : $(C_2H_5O)_n$
$M_A = (12.2 + 5 + 16)n = 45.2 \Rightarrow n = 2$
Vậy CTPT là $C_4H_{10}O_2$
Đúng 2
Bình luận (0)
\(n_{CO_2}=\dfrac{1.792}{22.4}=0.08\left(mol\right)\)
\(n_{H_2O}=\dfrac{1.8}{18}=0.1\left(mol\right)\)
\(n_O=\dfrac{1.8-0.08\cdot12-0.1\cdot2}{16}=0.04\left(mol\right)\)
\(n_C:n_H:n_O=0.08:0.2:0.04=2:5:1\)
Công thức đơn giản nhất : C2H5O
\(M_A=2\cdot45=90\left(\dfrac{g}{mol}\right)\)
\(\Rightarrow45n=90\)
\(\Rightarrow n=2\)
\(CT:C_4H_{10}O_2\)
Đúng 1
Bình luận (0)















