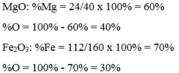Tính thành phần phần trăm theo khối lượng các nguyên tố hoá học có trong các hợp chât sau: CO2,K3PO4,FeSO4,SO3,Al2O3,CuSO4,5H2O

Những câu hỏi liên quan
Tìm thành phần phần trăm (theo khối lượng) các nguyên tố hóa học có trong những hợp chất sau:
a) CO và CO2.
b) Fe3O4 và Fe2O3.
c) SO2 và SO3.
a) Hợp chất CO có MCO = 12 + 16 = 28 g/mol
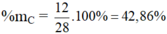
%mO = 100 – 42,86 = 57,14%
Hợp chất CO2: có MCO2 = 12 + 32 = 44 g/mol
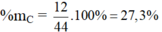
%mO = 100 – 27,3 = 72,7%
b) Hợp chất Fe3O4: MFe3O4 = 3.56 + 4.16 = 232 g/mol
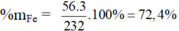
%mO = 100 – 72,4 = 27,6%
Hợp chất Fe2O3: MFe2O3 = 2.56 + 3.16 = 160 g/mol
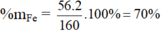
%mO = 100 – 70 = 30%
c) Hợp chất SO2 : MSO2 = 32 + 2.16 = 64 g/mol
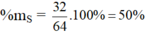
%mO = 100 – 50 = 50%
Hợp chất SO3 : MSO3 = 32 + 16.3 = 80 g/mol
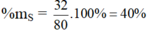
%mO = 100 – 40 = 60%
Đúng 2
Bình luận (0)
tìm thành phần phần trăm(theo khối lượng)các nguyên tố hoá học có trong những hợp chất sau:
a,CO và CO2 b,Fe3O4 và Fe2O3 c,SO2 vàSO3
a/
+ CO
%mC = \(\frac{12}{12+16}.100\%=42,86\%\)%mO = 100% - 42,86% =57,14%+CO2
%mC = \(\frac{12}{12+16.2}.100\%=27,27\%\) %mO = 100% - 27,27% = 72,73%b/
+Fe3O4
%mFe = \(\frac{56.3}{56.3+16.4}.100\%=72,41\%\) %mO = 100% - 72,41% = 27,59%+ Fe2O3
%mFe = \(\frac{56.2}{56.2+16.3}.100\%=70\%\) %mO = 100% - 70% = 30%c/
+SO2
%mS = \(\frac{32}{32+16.2}.100\%=50\%\)%mO = 100% - 50% = 50%+ SO3
%mS = \(\frac{32}{32+16.3}.100\%=40\%\) %mO = 100% - 40% = 60%
Đúng 1
Bình luận (0)
Tính thành phần phần trăm về khối lượng của mỗi nguyên tố trong các hợp chất sau: KOH,CaCO3,CO2,H2O,H2SO4,AL2O3
tìm thành phần phần trăm ( theo khối lượng ) của các nguyên tố hóa học có trong nhưng hợp chất sau
a/Fe2O3 b/Fe3O4 c/SO3 d/CuSO4 g/CH4
a) Fe2O3----> \(\dfrac{56.2}{56.2+16.3}.100\%=70\%\\ =>100\%-70\%=30\%\)
Đúng 1
Bình luận (0)
b) Fe3O4---->\(\dfrac{56.3}{56.3+16.4}.100\%=72,41\%\\ =>100\%-72,41\%=27,59\%\)
Đúng 1
Bình luận (0)
c)SO3---->\(\dfrac{32}{32+16.3}.100\%=40\%\\ =>100\%-40\%=60\%\)
Đúng 1
Bình luận (0)
Xem thêm câu trả lời
tính thành phần trăm theo khối lượng các nguyên tố trong hợp chất SO3
\(\%m_S=\dfrac{32}{80}.100\%=40\%\)
\(\%m_O=\dfrac{3.16}{80}.100\%=60\%\)
Đúng 1
Bình luận (0)
%S= \(\dfrac{32}{80}x100\%=40\%\)
=> %O= 100%-40%=60%
Đúng 0
Bình luận (0)
Xác định thành phần phần trăm theo khối lượng của các nguyên tố trong hợp chất khi biết công thức hoá học của hợp chất.Hợp chấtkhối lượng mình mol( M )Số mol nguyên tử của mỗi nguyên tố có trong 1 mol hợp chấtKhối lượng của mỗi nguyên tố có trong 1 mol hợp chấtThành phần phần trăm theo khối lượng của mỗi nguyên tố trong hợp chấtKMnO4 -Nêu các bước giải bài toán xác định thành phần phần trăm theo khối lượng của các nguyên tố trong hợp chất khi biết công thức hoá học của hợp chất ....
Đọc tiếp
Xác định thành phần phần trăm theo khối lượng của các nguyên tố trong hợp chất khi biết công thức hoá học của hợp chất.
| Hợp chất | khối lượng mình mol( M ) | Số mol nguyên tử của mỗi nguyên tố có trong 1 mol hợp chất | Khối lượng của mỗi nguyên tố có trong 1 mol hợp chất | Thành phần phần trăm theo khối lượng của mỗi nguyên tố trong hợp chất |
| KMnO4 |
-Nêu các bước giải bài toán xác định thành phần phần trăm theo khối lượng của các nguyên tố trong hợp chất khi biết công thức hoá học của hợp chất .
-Viết công thức tính thành phần phần trăm theo khối lượng của 1 nguyên tố trong hợp chất khi biết công thức hoá học của hợp chất.
Khối lượng mol :
MKMnO4 = 39 + 55 + 64 = 158 (g/mol)
Số mol nguyên tử của mỗi nguyên tố có trong 1 mol hợp chất :
nK = 1 mol
nMn = 1 mol
nO = 4 mol
Khối lượng của mỗi nguyên tố có trong 1 mol hợp chất :
mK = 39.1 = 39 (g)
mMn = 55.1 = 55 (g)
mO = 16.4 = 64 (g)
Thành phần phần trăm theo khối lượng của mỗi nguyên tố trong hợp chất :
\(\%m_K=\frac{m_K}{M_{KMnO_4}}.100\%=\frac{39}{158}.100\%=24,7\%\)
\(\%m_{Mn}=\frac{m_{Mn}}{M_{KMnO_4}}.100\%=\frac{55}{158}.100\%=34,8\%\)
\(\%m_O=\frac{m_O}{m_{KMnO_4}}.100\%=\frac{64}{158}.100\%=40,5\%\)
Đúng 0
Bình luận (5)
Các bước giải bài toán xác định thành phần phần trăm theo khối lượng của các nguyên tố trong hợp chất khi biết công thức hoá học của hợp chất :
B1 : Tính khối lượng mol (M) của hợp chất.
B2 : Tính số mol nguyên tử của mỗi nguyên tố có trong 1 mol hợp chất.
B3 : Tính khối lượng của mỗi nguyên tố có trong 1 mol hợp chất.
B4 : Tính thành phần phần trăm theo khối lượng của mỗi nguyên tố trong hợp chất.
Đúng 0
Bình luận (0)
Công thức tính thành phần phần trăm theo khối lượng của 1 nguyên tố trong hợp chất khi biết công thức hoá học của hợp chất :
\(\%m_A=\frac{m_A}{M_{h\text{/}c}}.100\%\)
Đúng 0
Bình luận (7)
Tính thành phần phần trăm theo khối lượng các nguyên tố hoá học có trong hợp chất đường mía (C¹² H²² O¹¹) (giúp mình vs ạhh, mik đang cần gấpp)
\(PTK=12.12+1.22+16.11=342< mol>.\)
\(\%C=\dfrac{12.12.100}{342}\approx42,11\%\)
\(\%H=\dfrac{1.22.100}{142}=15,49\%\)
\(\%O=100\%-42,11\%-15,49\%=42,4\%\)
Đúng 3
Bình luận (0)
Tìm thành phần phần trăm theo khối lượng các nguyên tố hóa học có trong những hợp chất sau: CuO, MgCO3, AgCl, HNO3, CO2, KMnO4, Ba(OH)2.
\(PTK_{CuO}=64+16=80\left(đvC\right)\)
\(\%m_{Cu}=\) \(\dfrac{64}{80}.100=80\%\)
\(\%m_O=100-80=20\%\)
\(PTK_{MgCO_3}=24+12+3.16=84\left(đvC\right)\)
\(\%m_{Mg}=\dfrac{24}{84}.100=28,57\%\)
\(\%m_C=\dfrac{12}{84}.100=14,28\%\)
\(\%m_O=\dfrac{3.16}{84}.100=57,14\%\)
các ý còn lại làm tương tự
Đúng 1
Bình luận (0)
Tính thành phần phần trăm (theo khối lượng) các nguyên tố hóa học có trong các hợp chất sau: MgO và F e 2 O 3 .
Tính thành phần % về khối lượng của nguyên tố oxi có trong hợp các chất: khí cacbon dioxit (CO2) và nhôm oxit (AL2O3). Từ đó hãy xác định trong hợp chất nào có nhiều oxi nhất (chiếm thành phần % theo khối lượng nguyên tố oxi cao nhất.)
Trong $CO_2$ : $\%O = \dfrac{16.2}{44}.100\% = 72,73\%$
Trong $Al_2O_3$ : $\%O = \dfrac{16.3}{102}.100\% = 47,06\%$
Suy ra: $\%O : CO_2 > Al_2O_3$
Đúng 2
Bình luận (0)