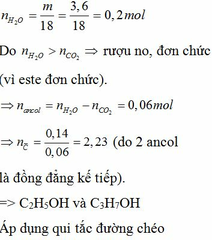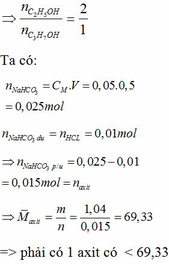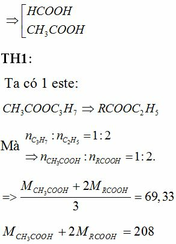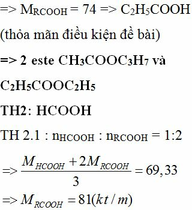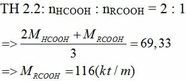Hoà tan hoàn toàn 27.4g hỗn hợp R2CO3 và RHCO3 bằng 500ml HCL 1M thoát ra 6.72l CO2 dktc Để trug hoà axit dư phải dùng 50ml dd NAOH 2M Tìm công thức 2 muối Tính % khối lượng 2muối ở hỗn hợp đầu

Những câu hỏi liên quan
Hòa tan hoàn toàn 27,4 g hỗn hợp muối gồm M3CO3 và MHCO3 ( M là kim loại kiềm hóa trị 1) bằng 500ml dd HCl 1M thấy thoát ra 6,72 lít CO2 ở đktc. Để trung hòa lượng axit còn dư phải dùng 50ml dd NaOH 2M .
a.Xác định 2 muối ban đầu và khối lượng của nó
b. tính V
Xem chi tiết
\(M_2CO_3+2HCl\rightarrow2MCl+H_2O+CO_2\)
a---------->2a--------------------------->a
\(MHCO_3+HCl\rightarrow MCl+H_2O+CO_2\)
b---------->b---------------------------->b
\(NaOH+HCl\rightarrow NaCl+H_2O\)
0,1----->0,1
\(\left\{{}\begin{matrix}a+b=n_{CO_2}=0,3\\2a+b+0,1=0,5\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,2\end{matrix}\right.\)
=> \(0,1\left(2M+60\right)+0,2\left(M+61\right)=27,4\Rightarrow M=23\)
M là Na
Hai muối ban đầu là \(Na_2CO_3,NaHCO_3\)
\(m_{Na_2CO_3}=0,1.106=10,6\left(g\right)\)
\(m_{NaHCO_3}=0,2.84=16,8\left(g\right)\)
b. Trong đề không có đề cập tới V bạn.
Đúng 2
Bình luận (0)
Hoà tan 27.4g hỗn hợp M2Co3 và MHCo3 bằng 500ml dung dịch HCl 1M thoát ra 6.72l Co2(đktc) để trung hoà axit dư phải dùng 50 ml NaOH 2M. Tìm 2 muối và % hỗn hợp
Hòa tan hoàn toàn 27,4g hỗn hợp gồm X2CO3 bằng 500ml dung dịch HCl 1M thấy thoát ra 6,72l khí CO2 (đktc). Để trung hòa lượng axit dư phải dung 50ml xút 2M
a) Xác định 2 muối ban đầu
b)Tính phần trăm khối lượng các muối
+nHCl(đầu)=1*0.5=0.5(mol)
+nCO2=6.72/22.4=0.3(mol)
X2CO3+2HCl=>2XCl+H2O+CO2
x----------->2x----->2x------>x--->x(m...
MHCO3+HCl=>MCl+H2O+CO2
y---------->y------>y----->y---->y(mol...
_Sau phản ứng còn dư dd axit được trung hòa bởi dd NaOH:
nNaOH=2*0.05=0.1(mol)
NaOH+HCl=>NaCl+H2O
0.1---->0.1(mol)
=>nHCl dư=0.1(mol)
=>nHClpư=0.5-0.1=0.4(mol)
Gọi x,y là số mol của X2CO3 và XHCO3:
x+y=0.3
2x+y=0.4
<=>x=0.1,y=0.2
=>m(X2CO3)=0.1(2X+60)g
=>m(XHCO3)=0.2(X+61)g
=>m=m(X2CO3)+m(XHCO3)=27.4
<=>0.2X+0.2X+9.2
<=>X=23(nhận)
Vậy X là Natri(Na)
Đúng 0
Bình luận (0)
hỗn hợp gồm X2CO3 và XHCO3 nha!(mk ghi thiếu)
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn 26.6g hỗn hợp 2 muối cacbonat axit và cacbonat trung tính của 1 kim loại kiềm bằng 200ml HCL 2M. Sau phản ứng phải trung hòa axit dư bằng 50ml dung dịch Ca(OH)2 1M. Tìm công thức 2 muối và khối lượng mỗi muối trong hỗn hợp
ta có
n M2CO3 : a
n MHCO3 : b
=> (2M + 60) a + (M + 61) b = 26,6
=> (2a+ b) M + 60a + 61b =26,6
=> 60 a + 61 b = 26,6 - 0,3 M (1)
M2CO3 + 2HCl => 2MCL + H2O + CO2
a--------------2a
MHCO3 + HCL => MCl + H2O + CO2
b------------------b
nHCL = 0,4
2HCl dư + Ca(OH)2 => CaCl2 + 2 H2O
0,1-------------0,05
n Ca(OH)2 = 0,05
=> 2a + b = 0,4 - 0,1 = 0,3 (2)
=> 2 pt mà 3 ẩn, thì mình chỉ còn cách này vậy
kim loại kiềm là KL hóa trị 1 thì chỉ có Na và K thoai
bạn thế Na vào pt (1) => giải hệ => số mol âm => loại
thế K vào ta có dc
{ a=0,055
{b=0,19
=> m K2CO3 = 7,59 (g)
m KHCO3 = 26,6 -75,9 = 19,01 (g)
Đúng 0
Bình luận (0)
hoà tan hoàn toàn 50,78 gam hỗn hợp gồm 2 muối cacbonat axit và cacbonat trung tính của kim loại kiềm thổ bằng 125ml dung dịch HNO3 4M. sau phản ứng phải trung hoà HCl dung dịch bằng 50ml KOH 1,2M. tìm công thức 2 muối và klg trong hỗn hợp mng giải chi tiết giúp em ạ em cảm ơn
Hòa tan hoàn toàn 27,4 g hỗn hợp muối gồm M3CO3 và MHCO3 ( M là kim loại kiềm hóa trị 1) bằng 500ml dd HCl 1M thấy thoát ra 6,72 lít CO2 ở đktc. Để trung hòa lượng axit còn dư phải dùng 50ml dd NaOH 2M . Xác định 2 muối ban đầu
Đặt a, b là số mol M2CO3 và MHCO3
\(\text{M2CO3 + 2HCl —> 2MCl + CO2 + H2O}\)
a...................2a................. 2a...........a
\(\text{MHCO3 + HCl —> MCl + CO2 + H2O}\)
b...................b..............b................b
\(\text{NaOH + HCl —> NaCl + H2O}\)
0,1..............0,1
\(\text{nCO2 = a + b = 0,3}\)
\(\text{nHCl = 2a + b + 0,1 = 0,5}\)
—> a = 0,1 và b = 0,2
—> 0,1(2M + 60) + 0,2(M + 61) = 27,4
—> M = 23: Na
Muối ban đầu Na2CO3 và NaHCO3.
\(\text{%Na2CO3 = 106a/27,4 = 38,69%}\)
\(\text{%NaHCO3 = 84b/27,4 =61,31%}\)
0
Đặt a, b là số mol M2CO3 và MHCO3
M2CO3 + 2HCl —> 2MCl + CO2 + H2O a…………….2a…………………..a
MHCO3 + HCl —> MCl + CO2 + H2O b…………..b…………………..b
NaOH + HCl —> NaCl + H2O
0,1……….0,1
nCO2 = a + b = 0,3
nHCl = 2a + b + 0,1 = 0,5
—> a = 0,1 và b = 0,2
—> 0,1(2M + 60) + 0,2(M + 61) = 27,4
—> M = 23: Na
Muối ban đầu Na2CO3 và NaHCO3.
%Na2CO3 = 106a/27,4 = 38,69%
%NaHCO3 = 84b/27,4 =61,31%
Bài 1: Hoà tan hoàn toàn 17,2g hỗn hợp kim loại kiềm X và oxit của nó vào 600g nươc thì thu được dd Y và 0,2g khí, cô cạn dd Y thì thu được 22,4g chất rắn khan. Xác định kim loại X và % khối lượng các chất trong hỗn hợp ban đầu. Tính thể tích dd H2SO4 cần dùng để trung hoà dd YBài 2: hỗn hợp 3 ôxít Al2O3,MgO, Fe2O3 nặng 30g. Nếu hoà tan hỗn hợp bằng H2SO4 49% cần dùng hết 158g dd axit. Nếu hoà tan hỗn hợp bằng dd NaOH 2M thì thể tích dd NaOH phản ứng là 200ml. Tìm % khối lượng mỗi oxit
Đọc tiếp
Bài 1: Hoà tan hoàn toàn 17,2g hỗn hợp kim loại kiềm X và oxit của nó vào 600g nươc thì thu được dd Y và 0,2g khí, cô cạn dd Y thì thu được 22,4g chất rắn khan. Xác định kim loại X và % khối lượng các chất trong hỗn hợp ban đầu. Tính thể tích dd H2SO4 cần dùng để trung hoà dd Y
Bài 2: hỗn hợp 3 ôxít Al2O3,MgO, Fe2O3 nặng 30g. Nếu hoà tan hỗn hợp bằng H2SO4 49% cần dùng hết 158g dd axit. Nếu hoà tan hỗn hợp bằng dd NaOH 2M thì thể tích dd NaOH phản ứng là 200ml. Tìm % khối lượng mỗi oxit
Đun nóng hỗn hợp hai este đơn chức với dd NaOH vừa đủ thu được hỗn hợp 2 rượu đồng đẳng kế tiếp và hỗn hợp 2 muối. Đốt cháy hoàn toàn một lượng hỗn hợp rượu trên thu được 3,136 lít khí CO2 (đktc) và 3,6 gam H2O. Cho hỗn hợp hai muối trên tác dụng với dd H2SO4 vừa đủ được hỗn hợp hai axit cacboxylic. Cho từ từ 50ml dd NaHCO3 0,5M vào cốc đựng 1,04 gam hỗn hợp hai axit thu được ở trên, sau phản ứng cần phải dùng 10ml dd HCl 1M mới tác dụng vừa hết với lượng NaHCO3 dư. Xác định công thức cấu tạo củ...
Đọc tiếp
Đun nóng hỗn hợp hai este đơn chức với dd NaOH vừa đủ thu được hỗn hợp 2 rượu đồng đẳng kế tiếp và hỗn hợp 2 muối. Đốt cháy hoàn toàn một lượng hỗn hợp rượu trên thu được 3,136 lít khí CO2 (đktc) và 3,6 gam H2O. Cho hỗn hợp hai muối trên tác dụng với dd H2SO4 vừa đủ được hỗn hợp hai axit cacboxylic. Cho từ từ 50ml dd NaHCO3 0,5M vào cốc đựng 1,04 gam hỗn hợp hai axit thu được ở trên, sau phản ứng cần phải dùng 10ml dd HCl 1M mới tác dụng vừa hết với lượng NaHCO3 dư. Xác định công thức cấu tạo của hai este có trong hỗn hợp đầu. Biết khi đốt cháy 1 mol mỗi este thu được không quá 5mol CO2.
Hoà tan hoàn toàn 5,59 g hỗn hợp hợp 1 muối cacbonat của kim loại hóa trị 2 bằng dd HCL thấy thoát ra 1,233l khí CO2 (đktc) CÔ cạn dd sau phản ứng thì thư đ. Khối lượng muối khan là
Hoà tan hoàn toàn 12,9 gam hỗn hợp gồm Fe và Zn bằng môt lượng vừa đủ 200 ml dd H2SO4 1M loãng và HCl 2M thấy thoát ra V lít khí đktc.
a. Tính V
b. Tính tổng khối lượng chất tan có trong dd sau phản ứng.
ta có lượng \(H^+\) có trong dung dịch là :
\(n_{H^+}=2n_{H_2SO_4}+n_{HCL}=2\times0,2\times1+0,2\times2=0,8\left(mol\right)\)
a. ta có \(n_{H_2}=\frac{1}{2}n_{H^+}=0,4mol\Rightarrow V_{H_2}=22,4\times0,4=8,96\left(lit\right)\)
b. ta có \(m_{\text{hỗn hợp}}+m_{\text{axit }}=m_{\text{chất tan}}+m_{\text{ khí}}\)
nên \(m_{\text{chất tan }}=12,9+0,2\times98+0,4\times36,5-0,4\times2=46,3\left(g\right)\)