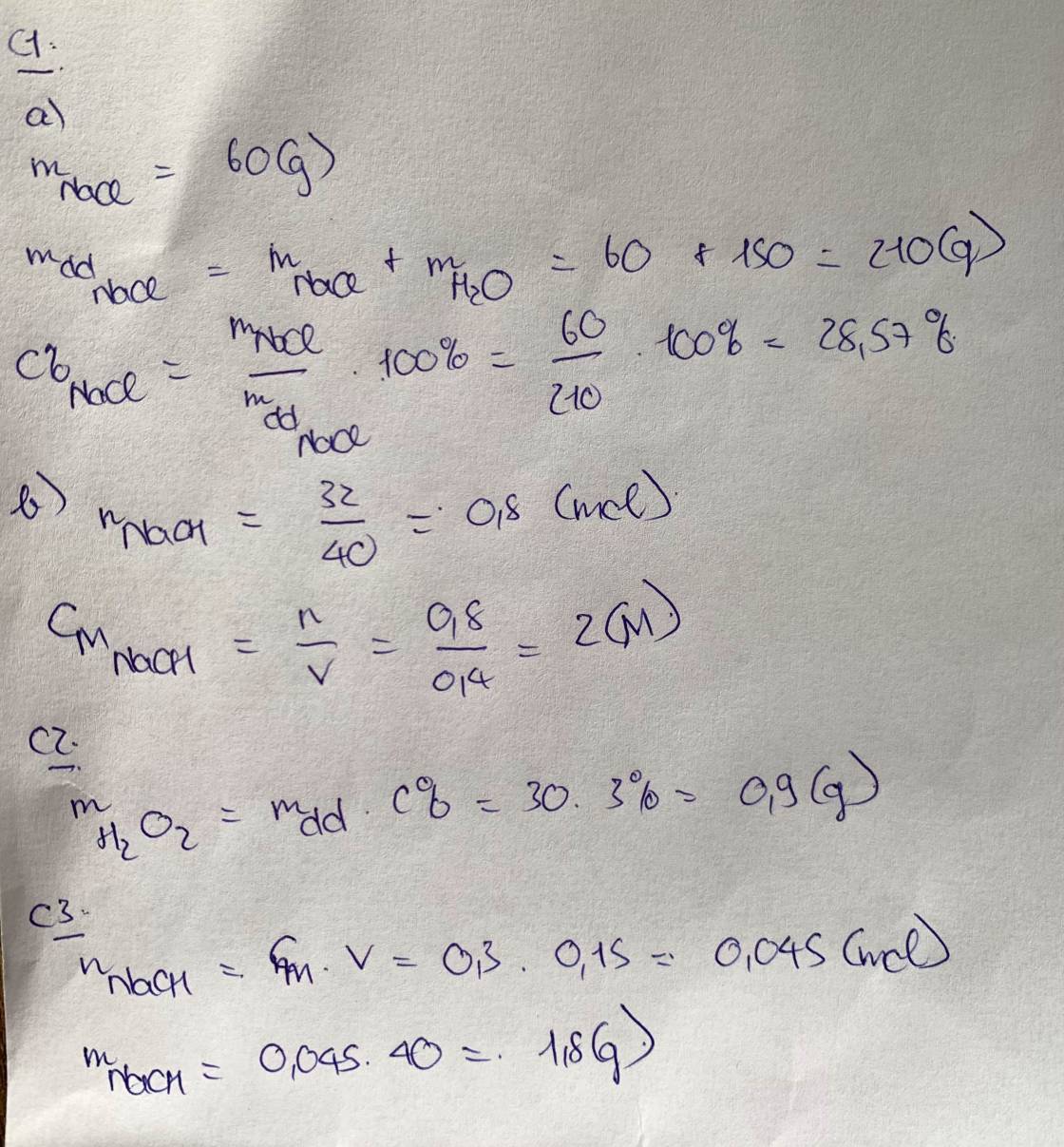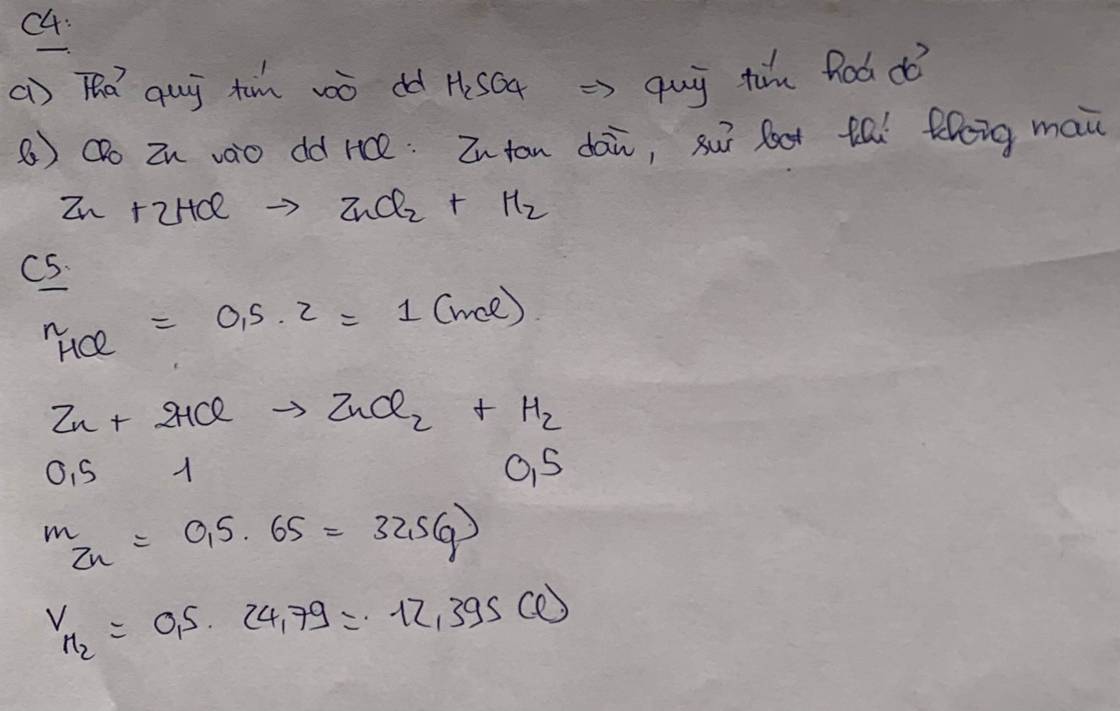tính nồng độ phần trăm của dung dịch nacl khi hòa tan 0.2 mol nacl vào 288.3 gam nước

Những câu hỏi liên quan
Tính nồng độ phần trăm của dung dịch thu được:
a) Hòa tan 9 gam NaCl vào 91 gam nước
b) Hòa tan 0,5 mol NaCl vào 300 ml nước
a.\(C\%_{NaCl}=\dfrac{9}{91+9}.100\%=9\%\)
b.\(m_{NaCl}=0,5.58,5=29,25g\)
\(C\%_{NaCl}=\dfrac{29,25}{29,25+300}.100\%=8,88\%\)
Đúng 1
Bình luận (0)
5.
Tính nồng độ phần trăm của dung dịch thu được:
a) Hòa tan 9 gam NaCl vào 91 gam nước
b) Hòa tan 0,5 mol NaCl vào 300 ml nước
a) \(C\%=\dfrac{9}{9+91}.100\%=9\%\)
b) \(m_{H_2O}=300.1=300\left(g\right)\)
\(C\%=\dfrac{0,5.58,5}{0,5.58,5+300}.100\%=8,88\%\)
Đúng 4
Bình luận (0)
Câu 1 a. Hòa tan 60 gam NaCl vào 150 gam nước. Tính nồng độ phần trăm của dung dịch thu được.b.Tính nồng độ mol của dung dịch khi hòa tan 32 gam NaOH trong 400ml nước. (coi thể tích dung dịch không đổi).Câu 2 Hãy tính khối lượng H2O2 có trong 30 g dung dịch nồng 3% .Câu 3 Tính khối lượng của NaOH có trong 300 ml dung dịch có nồng độ 0,15 M.Cho Na 23; O 16; H1.Câu 4Hãy nêu , giải thích được hiện tượng xảy ra trong thí nghiệm và viết phương trình hoá học .Từ đó rút ra nhận xét về tính chất...
Đọc tiếp
Câu 1
a. Hòa tan 60 gam NaCl vào 150 gam nước. Tính nồng độ phần trăm của dung dịch thu được.
b.Tính nồng độ mol của dung dịch khi hòa tan 32 gam NaOH trong 400ml nước. (coi thể tích dung dịch không đổi).
Câu 2 Hãy tính khối lượng H2O2 có trong 30 g dung dịch nồng 3% .
Câu 3 Tính khối lượng của NaOH có trong 300 ml dung dịch có nồng độ 0,15 M.
Cho Na= 23; O= 16; H=1.
Câu 4
Hãy nêu , giải thích được hiện tượng xảy ra trong thí nghiệm và viết phương trình hoá học .Từ đó rút ra nhận xét về tính chất của acid khi thực hiện các thí nghiệm sau:
a.Thả miếng giấy quì tím vào lọ đựng dung dịch sulfuric acid (H2SO4)
b.Cho viên kẽm (zinc) vào trong ống nghiệm có chứa dung dịch hydrochloric acid.
Câu 5
Cho kẽm (Zinc) dư tác dụng với 500 ml dung dịch hydrochloric acid 2 M, thu được V (lít) khí hydrogen (250C và 1 bar).
Tính khối lượng kẽm đã phản ứng và thể tích khí hydrogen thu được.
Hòa tan 30 g NaCl vào 170 gam nước, được dung dịch có khối lượng riêng 1,1 gam/ml. Tính nồng độ phần trăm và nồng độ mol của dung dịch thu được
\(C\%=\dfrac{30}{170}.100\%=17,647\%\)
\(V_{\text{dd}}=\left(30+170\right)1,1=220ml\)
\(n_{NaCl}=\dfrac{30}{58,5}=0,513mol\)
\(C_M=\dfrac{0,513}{0,22}=0,696M\)
\(C\%_{NaCl}=\dfrac{30}{170+30}.100\%=15\%\\ C_M=C\%.\dfrac{10D}{M}=10.\dfrac{10.1,1}{58,5}=1,88M\)
Đúng 1
Bình luận (1)
a)Trong 100ml dung dịch có hòa tan 40g CuSo4. Tính nồng độ mol của dung dịch b) hòa tan 30 g NaCl vào 170 g nước . Tính nồng độ phần trăm của dung dịch
nCuSO4=40/160=0,25 mol
CM CuSO4 =0,25/0,1=2,5M
nNaCl = 30/58,5=20/39 mol
nH2O = 170 /18=85/9 mol
2NaCl + 2H2O --> Cl2 + H2 + 2NaOH
20/39 10/39 10/39 20/39 mol
ta thấy nNaCl/2<nH2O/2
=> NaCl hết , H2O dư
=>mNaOH=20/39*20\(\approx\)20,51 g
m dd sau = 30 + 170 - 10/39*35,5-10,39*2\(\approx\)190,38 g
C% NaOh = 20,51*100/190,38=10,77%
Đúng 1
Bình luận (0)
a,có 60 g NaCl trong 1250g dung dịch . tính nồng độ phần trăm của dung dịch KCL
b, hòa tan 0,5 mol Na2CO3 vào nước thu được 500 ml dung dịch . tính nồng độ mol của dung dịch CuSO4
a) Ta có: \(C\%_{NaCl}=\dfrac{60}{60+1250}\cdot100\%\approx4,58\%\)
b) Ta có: \(C_{M_{Na_2CO_3}}=\dfrac{0,5}{0,5}=1\left(M\right)\)
Đúng 3
Bình luận (0)
Biết ở 250C, 300 gam nước hòa tan được 108 gam NaCl để tạo thành dung dịch bão hòa. Tính độ tan
của NaCl ? Tính nồng độ phần trăm của dung dịch bão hòa thu được?
$S_{NaCl} = \dfrac{m_{NaCl}}{m_{H_2O}}.100 = \dfrac{108}{300}.100 = 36(gam)$
$C\%_{NaCl} = \dfrac{m_{NaCl}}{m_{NaCl} + m_{H_2O}} = \dfrac{108}{108 + 300}.100\% = 26,47\%$
Đúng 0
Bình luận (0)
Ở 30 độC hòa tan 114g NaCL vào 300g nước thì thu được dung dịch bão hòa.
a. tính độ tan của NaCL?
b.tính nồng độ phần trăm của dung dịch?
\(S=\dfrac{114}{300}.100=38\left(g\right)\\ C\%=\dfrac{114}{300+114}.100\%=27,53\% \)
Đúng 2
Bình luận (0)
S=114/300.100=38(g)
C%=114/300+114.100%=27,53%
Đúng 1
Bình luận (0)
- Tính nồng độ phần trăm của dung dịch:
VD; + Hòa tan 20 g NaOH vào 150g nước. tính nồng độ phần trăm của dung dịch thu được.
+ Tính nồng độ phần trăm của 150 g dung dịch NaCl có chứa 50 g NaCl.
- phân loại, gọi tên các hợp chất : oxi, axit, bazo, muối:
Vd: Gọi tên và phân loại các chất sau: CaO, CuO, HCl, H3PO4, H2SO4, NaOH, Ca(OH)2, CaCO3, CuSO4, NaCl.
- bài toán xác định lượng chất dư khi 2 chất phản ứng với nhau:
vd: Cho 26 gam kẽm vào dung dịch chứa 36,5 gam axit clohiđric (HCl).
a) Viết ph...
Đọc tiếp
- Tính nồng độ phần trăm của dung dịch: VD; + Hòa tan 20 g NaOH vào 150g nước. tính nồng độ phần trăm của dung dịch thu được. + Tính nồng độ phần trăm của 150 g dung dịch NaCl có chứa 50 g NaCl. - phân loại, gọi tên các hợp chất : oxi, axit, bazo, muối: Vd: Gọi tên và phân loại các chất sau: CaO, CuO, HCl, H3PO4, H2SO4, NaOH, Ca(OH)2, CaCO3, CuSO4, NaCl. - bài toán xác định lượng chất dư khi 2 chất phản ứng với nhau: vd: Cho 26 gam kẽm vào dung dịch chứa 36,5 gam axit clohiđric (HCl). a) Viết phương trình hóa học phản ứng xảy ra ? b) Chất nào còn dư sau phản ứng, khối lượng dư là bao nhiêu gam? c) Tính thể tích chất khí H2 sinh ra sau phản ứng (ở đktc) ? - tính chất hóa học của hidro oxi, điều chế oxi, hidro - cách nhận biết axit, bazo băng quì tím - Tính chất hóa học của nước.