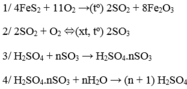Từ 120kg FeS2 người ta sản xuất được 170kg H2SO4 .tính H% toàn bộ hóa trình .

Những câu hỏi liên quan
Từ 120kg quặng FeS2 ngta sản xuất đc 147kg axit sunfuric. Tính toàn bộ quá trình. Giúp e vs ạ
Từ 120kg FeS2 có thể sản xuất đc bao nhiêu kg axit H2SO4 98%? Biết hiệu suất của cả quá trình là 80%
$n_{FeS_2} = \dfrac{120}{120} = 1(kmol)$
$n_{FeS_2\ pư} = 1.80\% = 0,8(kmol)$
Bảo toàn nguyên tố với S :
$n_{H_2SO_4} = 2n_{FeS_2\ pư} = 1,6(kmol)$
$m_{dd\ H_2SO_4} = \dfrac{1,6.98}{98\%} = 160(kg)$
Đúng 1
Bình luận (1)
Trong công nghiệp người ta sản xuất axít sunfuric theo sơ đồ sau: FeS2
→
SO2
→
SO3
→
H2SO4 . Người ta sử dụng 15 tấn quặng pirit sắt (chứa 80% FeS2) để sản xuất ra 39,2 tấn dung dịch H2SO4 40%. Vậy hiệu suất chung cho cả quá trình sản xuất axít sunfuric từ quặng trên là: A. 40% B. 60% C. 80% D. 62,5%
Đọc tiếp
Trong công nghiệp người ta sản xuất axít sunfuric theo sơ đồ sau: FeS2 → SO2 → SO3 → H2SO4 . Người ta sử dụng 15 tấn quặng pirit sắt (chứa 80% FeS2) để sản xuất ra 39,2 tấn dung dịch H2SO4 40%. Vậy hiệu suất chung cho cả quá trình sản xuất axít sunfuric từ quặng trên là:
A. 40%
B. 60%
C. 80%
D. 62,5%
Trong công nghiệp người ta sản xuất axit sunfuric theo sơ đồ sau: FeS2 → SO2 → SO3 → H2SO4. Người ta sử dụng 15 tấn quặng pirit sắt (chứa 80% FeS2) để sản xuất ra 39,2 tấn dung dịch H2SO4 40%. Vậy hiệu suất chung cho cả quá trình sản xuất axit sunfuric từ quặng trên là: A. 40%. B. 60%. C. 80%. D. 62,5%
Đọc tiếp
Trong công nghiệp người ta sản xuất axit sunfuric theo sơ đồ sau:
FeS2 → SO2 → SO3 → H2SO4.
Người ta sử dụng 15 tấn quặng pirit sắt (chứa 80% FeS2) để sản xuất ra 39,2 tấn dung dịch H2SO4 40%. Vậy hiệu suất chung cho cả quá trình sản xuất axit sunfuric từ quặng trên là:
A. 40%.
B. 60%.
C. 80%.
D. 62,5%
Đáp án C.
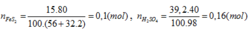
FeS2→ 2H2SO4
0,08 ← 0,16 (mol)
H% = 0,08.100/0,1= 80%
Đúng 0
Bình luận (0)
Axit sunfuric H2SO4 là một trong những hóa chất có ứng dụng hàng đầu trong đời sống như: sản xuất phân bón, thuốc trừ sâu, chất giặt rửa tổng hợp, tơ sợi hóa học, chất dẻo, sơn, dược phẩm. Trên thế giới mỗi năm người ta sản xuất khoảng 160 triệu tấn H2SO4 từ lưu huỳnh hoặc quặng pirit FeS2 theo sơ đồ sau: a. Hoàn thành sơ đồ chuyển hóa trên (ghi rõ điều kiện phản ứng nếu có) b. Trong thực tế sản xuất, để an toàn người ta không hấp thụ trực tiếp SO3 vào nước mà hấp thụ SO2 vào H2SO4 đặc để tạot...
Đọc tiếp
Axit sunfuric H2SO4 là một trong những hóa chất có ứng dụng hàng đầu trong đời sống như: sản xuất phân bón, thuốc trừ sâu, chất giặt rửa tổng hợp, tơ sợi hóa học, chất dẻo, sơn, dược phẩm. Trên thế giới mỗi năm người ta sản xuất khoảng 160 triệu tấn H2SO4 từ lưu huỳnh hoặc quặng pirit FeS2 theo sơ đồ sau:
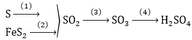
a. Hoàn thành sơ đồ chuyển hóa trên (ghi rõ điều kiện phản ứng nếu có)
b. Trong thực tế sản xuất, để an toàn người ta không hấp thụ trực tiếp SO3 vào nước mà hấp thụ SO2 vào H2SO4 đặc để tạothành Oleum (H2SO4.nSO3). Tùy theo mục đích sử dụng người ta hòa tan Oleum vào nước để thu được dung dịch H2SO4 có nồng độ theo yêu cầu. Hòa tan hoàn toàn 16,9 gam Oleum vào nước thu được 25 gam dung dịch H2SO4 78,4%. Xác định công thức của Oleum.
trong công nghiệp người ta điều chế H2SO4 từ quặng pirit sắt có thành phần chính là FeS2 theo sơ đồ sau
FeS2->SO2->SO3->H2SO4
a) hoàn thành sơ đồ trên bằng các phương trình hóa học (ghi rõ điều kiện)
b) tính khối lượng H2SO4 98% điều chế được từ 1 tấn quặng chứa 60% FeS2 .Biết hiệu của cả quá trình là 80%
Xem chi tiết
a)
\(4FeS_2 + 11O_2 \xrightarrow{t^o} 2Fe_2O_3 + 4SO_2\\ 2SO_2 + O_2 \xrightarrow{t^o,V_2O_5} 2SO_3\\ SO_3 + H_2O \to H_2SO_4\)
b)
\(m_{FeS_2} = 1000.60\% = 600(kg)\\ n_{FeS_2} = \dfrac{600}{120} = 5(kmol)\\ \Rightarrow n_{FeS_2\ pư} = 5.80\% = 4(kmol)\)
Bảo toàn nguyên tố với S : \(n_{H_2SO_4} = 2n_{FeS_2} = 4.2 = 8(kmol)\)
Suy ra :
\(m_{H_2SO_4} = 8.98 = 784(kg)\\ \Rightarrow m_{dd\ H_2SO_4} = \dfrac{784}{98\%} =800(kg)\)
Đúng 1
Bình luận (0)
Câu 3: Để sản xuất axit sunfuric (H2SO4) là một hóa chất quan trọng trong nhiều ngành sản xuất người ta dùng nguyên liệu là quặng pirit sắt (FeS2). Ban đầu người ta đem nghiền nhỏ quặng pirit sắt rồi nung ở nhiệt độ cao thu được sắt (III) oxit (Fe2O3) và khí sunfurơ (SO2). Sau đó oxi hóa khí sunfurơ bằng oxi với xúc tác thích hợp ở 450 oC thu được lưu huỳnh trioxit (SO3). Cuối cùng cho lưu huỳnh trioxit vào nước người ta thu được axit sunfuric.(a) Hãy cho biết trong quá trình trên giai đoạn nào...
Đọc tiếp
Câu 3: Để sản xuất axit sunfuric (H2SO4) là một hóa chất quan trọng trong nhiều ngành sản xuất người ta dùng nguyên liệu là quặng pirit sắt (FeS2). Ban đầu người ta đem nghiền nhỏ quặng pirit sắt rồi nung ở nhiệt độ cao thu được sắt (III) oxit (Fe2O3) và khí sunfurơ (SO2). Sau đó oxi hóa khí sunfurơ bằng oxi với xúc tác thích hợp ở 450 oC thu được lưu huỳnh trioxit (SO3). Cuối cùng cho lưu huỳnh trioxit vào nước người ta thu được axit sunfuric.
(a) Hãy cho biết trong quá trình trên giai đoạn nào xảy ra hiện tượng vật lí? Giai đoạn nào xảy ra hiện tượng hóa học? Giải thích.
(b) Viết phương trình chữ của phản ứng hóa học.
II-Tự luậnAxit sunfuric là hóa chất hàng đầu được dùng trong nhiều ngành công nghiệp. Hàng năm, các nước trên thế giới sản xuất ra khoảng 160 triệu tấn. Viết PTHH sản xuất
H
2
S
O
4
từ
F
e
S
2
theo sơ đồ:
F
e
S
2
→
S
O
2
→
S
O
3...
Đọc tiếp
II-Tự luận
Axit sunfuric là hóa chất hàng đầu được dùng trong nhiều ngành công nghiệp. Hàng năm, các nước trên thế giới sản xuất ra khoảng 160 triệu tấn. Viết PTHH sản xuất H 2 S O 4 từ F e S 2 theo sơ đồ: F e S 2 → S O 2 → S O 3 → o l e u m → H 2 S O 4 .
Tính khối lượng FES2 cần dùng để sản xuất 200kg axit H2SO4 . Biết hiệu suất của cả quá trình là 80% .(xin mọi người đừng giải bảo toàn nguyên tố vì mình chưa học)
Ta có sơ đồ
FeS2--->2H2SO4
120g 2.98g
6000/49kg 200kg
Vì hiệu suất 80% nên mFeS2=6000/49 .100/80=153,06kg
Đúng 2
Bình luận (0)