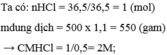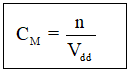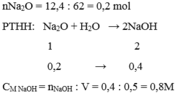tính nồng độ mol của 500ml dung dịch có hòa tan 55,5 gam cacl2

Những câu hỏi liên quan
a. hòa tan 9,2 gam Na2O vào nước thì thu được 500ml dung dịch. tính nồng độ mol của dung dịch?
b. hòa tan 37,6 gam K2O vào 362,4 gam nước . tính nồng độ phần trăm của dung dịch?
Sửa đề: 9,2 gam Na
\(a,n_{Na_2O}=\dfrac{9,2}{23}=0,4\left(mol\right)\)
PTHH: \(Na_2O+H_2O\rightarrow2NaOH\)
0,4------------------>0,8
\(\rightarrow C_{M\left(NaOH\right)}=\dfrac{0,8}{0,5}=1,6M\)
\(b,n_{K_2O}=\dfrac{37,6}{94}=0,4\left(mol\right)\)
PTHH: \(K_2O+H_2O\rightarrow2KOH\)
0,4----------------->0,8
\(\rightarrow C\%_{KOH}=\dfrac{0,8.56}{362,4+37,6}.100\%=11,2\%\)
Đúng 1
Bình luận (0)
Hòa tan 36,5 gam HCl vào nước, thu được 500ml dung dịch có khối lượng riêng D = 1,1 g/ml. Tính nồng độ mol và nồng độ phần trăm của dung dịch thu được.
Trong 500ml dung dịch có hòa tan 11,7g NaCl. Tính nồng độ mol của dung dịch NaCl
Hòa tan 23,5g K2O vào nước thành 500ml dung dịch
a)Tính nồng độ mol của dung dịch thu được
b)Tính thể tính dung dịch H2So4 20% (D=1,14g/ml) cần để trung hòa dung dịch trên
c)Tính nồng độ mol của chất tan trong dung dịch sau PỨ
![]()
\(n_{K_2O}=\dfrac{23.5}{94}=0.25\left(mol\right)\)
\(K_2O+H_2O\rightarrow2KOH\)
\(0.25...................0.5\)
\(C_{M_{KOH}}=\dfrac{0.5}{0.5}=1\left(M\right)\)
\(2KOH+H_2SO_4\rightarrow K_2SO_4+H_2O\)
\(0.5............0.25............0.25\)
\(m_{dd_{H_2SO_4}}=\dfrac{0.25\cdot98}{20\%}=122.5\left(g\right)\)
\(V_{dd_{H_2SO_4}}=\dfrac{122.5}{1.14}=107.5\left(ml\right)=0.1075\left(l\right)\)
\(C_{M_{K_2SO_4}}=\dfrac{0.25}{0.1075+0.5}=0.4\left(M\right)\)
Đúng 3
Bình luận (0)
nK2O = 23,5 : 94 = 0,25 (mol)
Vdd = 500ml = 0,5l
PT K2O + H2O ==> 2KOH
TPT 1 1 2 (mol)
TĐB: 0,25 --> 0,5 (mol)
a) CM KOH = 0,5 : 0,5 = 1(M)
b) PT: H2SO4 + 2KOH ==> K2SO4 + 2H2O
TPT: 1 2 1 2 (mol)
Đúng 1
Bình luận (1)
a.
\(n_{K_2O}=\dfrac{m}{M}=\dfrac{23,5}{94}=0,25\left(mol\right)\\ PT:\\ K_2O+H_2O\rightarrow2KOH\)
Theo pt: \(n_{KOH}=2n_{K_2O}=0,5\left(mol\right)\)
\(\Rightarrow C_{M\left(KOH\right)}=\dfrac{n}{V}=\dfrac{0,5}{0,5}=1\left(M\right)\)
b.
\(PT:\\ 2KOH+H_2SO_4\rightarrow K_2SO_4+2H_2O\)(2)
Theo pt, \(n_{H_2SO_4}=\dfrac{1}{2}n_{KOH}=0,25\left(mol\right)\)
\(\Rightarrow V_{ddH_2SO_4}=\dfrac{m_{dd}}{D}=\dfrac{n.M:C\%}{D}=\dfrac{0,25.98:20\%}{1,14}=\)107,46(ml)
c.
dd spư có chất tan là K2SO4
Theo pt (2), \(n_{K_2SO_4}=\dfrac{1}{2}n_{KOH}=0,25\left(mol\right)\)
=> CM = \(\dfrac{n}{V}=\dfrac{0,25}{0,107}=2,336\left(M\right)\)
Đúng 0
Bình luận (2)
Hòa tan hết 12,4 gam Natrioxit vào nước thu được 500ml dung dịch A . Nồng độ mol của dung dịch A là :
A. 0,8M
B. 0,6M
C. 0,4M
D. 0,2M
Hòa tan hết 12,4 gam Natrioxit vào nước thu được 500ml dung dịch A . Nồng độ mol của dung dịch A là :
nNa2O=12.4/62=0.2 mol
Na2O + H2O➞2NaOH
0.2 0.4 mol
nNaOH=0.2*2/1=0.4 mol
CM=0.4/0.4=1 M
Đúng 0
Bình luận (0)
hòa tan hết 12,4 gam Natri oxit (Na2O) vào nước thu được 500ml dung dịch NaOH Tính nồng độ mol của dung dịch bazơ thu được. (Biết Na=23, O=16
\(n_{Na_2O}=\dfrac{12,4}{62}=0,2mol\)
\(Na_2O+H_2O\rightarrow2NaOH\)
0,2 \(\rightarrow\) 0,2 \(\rightarrow\) 0,4
\(C_{M_{NaOH}}=\dfrac{0,4}{\dfrac{500}{1000}}=0,8M\)
Đúng 1
Bình luận (0)
Hòa tan 47,4 gam phèn chua (KAl(SO4)2.12H2O) và 11,4 gam [Cu(NH3)4]SO4 vào nước để thu được 500ml dung dịch. Tính nồng độ mol của SO42- ? A. 0,25 B. 0,4 C. 0,3 D. 0,5
Đọc tiếp
Hòa tan 47,4 gam phèn chua (KAl(SO4)2.12H2O) và 11,4 gam [Cu(NH3)4]SO4 vào nước để thu được 500ml dung dịch. Tính nồng độ mol của SO42- ?
A. 0,25
B. 0,4
C. 0,3
D. 0,5
Đáp án D
Số mol KAl(SO4)2.12H2O và [Cu(NH3)4]SO4 lần lượt là 0,1 mol và 0,05 mol
Số mol SO42- là: 0,1.2 + 0,05= 0,25 mol
[SO42-]= 0,25/0,5= 0,5 M
Đúng 0
Bình luận (0)
hòa tan 500ml dung dịch H2SO4 0,5M vào 300ml dung dịch H2SO4 1,5M tính nồng độ mol của dung dịch thu được
\(C_{M\left(dd.H_2SO_4.sau.khi.trộn\right)}=\dfrac{0,5.0,5+0,3.1,5}{0,5+0,3}=0,875M\)
Đúng 3
Bình luận (0)