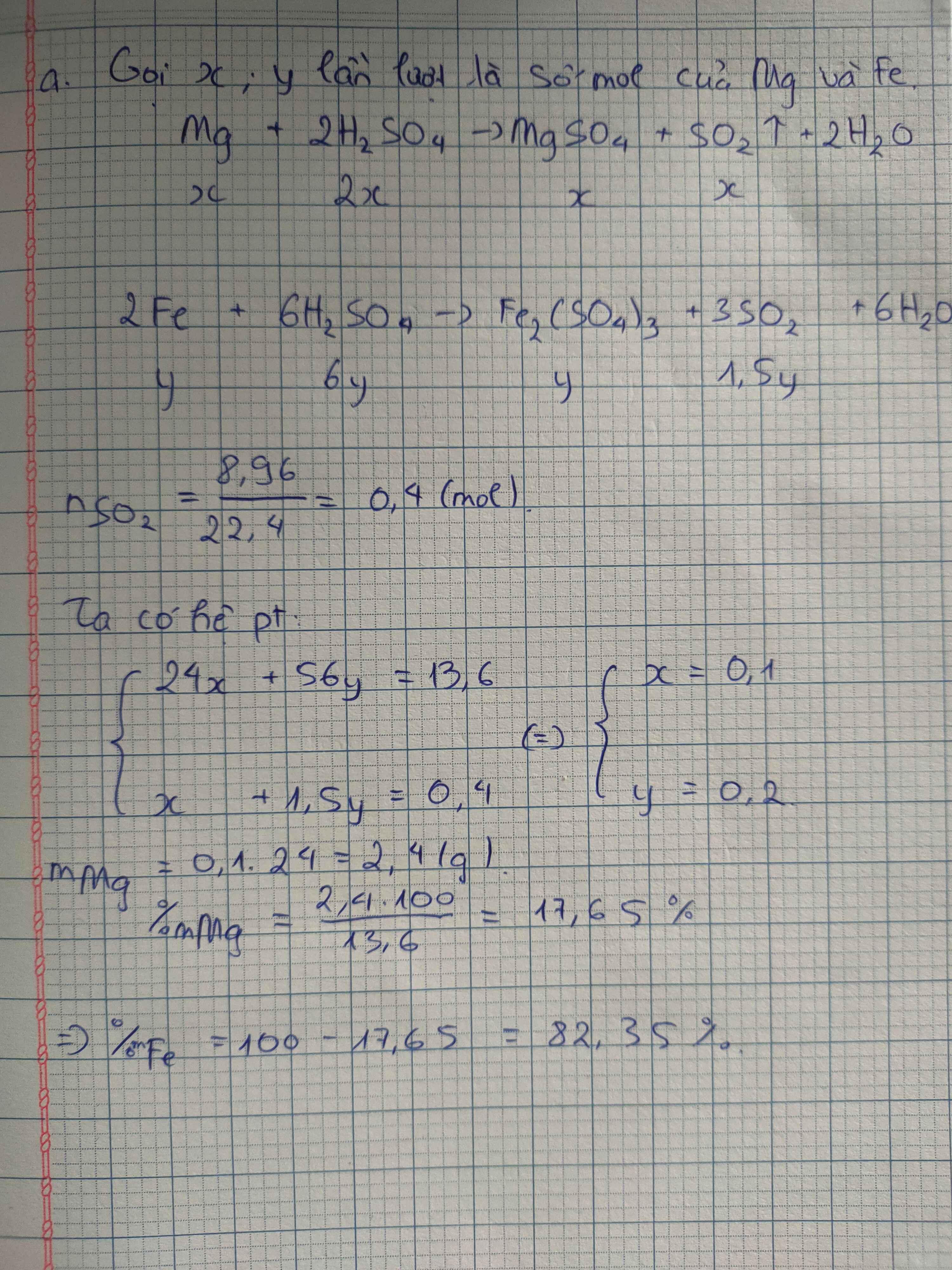Cho 18,4g hỗn hợp Fe và Mg phản ứng với dd H2SO4 đặc nóng thu đc 13,44l SO2 đktc và dd A
a.Xác định phần trăm khối lượng mỗi kim loại
b.Nếu cho hỗn 


Những câu hỏi liên quan
Cho 11g hỗn hợp Al, Fe phản ứng hoàn toàn với H2SO4 đặc nóng dư, thu được 10,08 lít SO2 sản phẩm khử duy nhất ở đktc và đúng dịch A. a. Tính % theo khối lượng của mỗi kim loại trong hỗn hợp. b. Tính khối lượng dd H2SO4 đã dùng biết dd H2SO4 có nồng độ 98% và đã dùng dư 20% so lượng cần thiết đểu phản ứng.
cho 6,8 gam Fe và Mg trong dung dịch H2 SO4 loãng thu được 3,36 lít khí ( đktc )a) Tính phần trăm khối lượng mỗi kim loại có trong hỗn hợpb) Cho 6,8 gam hỗn hợp trên vào dd H2SO4 đặc 75% nóng dư, thu được V lít khí SO2 ( đkc, sản phẩm khử duy nhất ). Tìm V và khối lượng dung dịch axit đem dùng nếu biết lượng dư là 10% so với phản ứng ?( giải bài toán có sử dụng định luật bảo toàn e, bảo toàn nguyên tố )
Đọc tiếp
cho 6,8 gam Fe và Mg trong dung dịch H2 SO4 loãng thu được 3,36 lít khí ( đktc )
a) Tính phần trăm khối lượng mỗi kim loại có trong hỗn hợp
b) Cho 6,8 gam hỗn hợp trên vào dd H2SO4 đặc 75% nóng dư, thu được V lít khí SO2 ( đkc, sản phẩm khử duy nhất ). Tìm V và khối lượng dung dịch axit đem dùng nếu biết lượng dư là 10% so với phản ứng ?
( giải bài toán có sử dụng định luật bảo toàn e, bảo toàn nguyên tố )
Cho 18 gam hỗn hợp Cu và Fe phản ứng hết với dung dịch H2SO4 đặc, nóng thấy thoát ra 8,4 lít khí SO2 (sản phẩm khử duy nhất, đktc). a. Tính khối lượng mỗi kim loại trong hỗn hợp. b. Tính thành phần phần trăm khối lượng mỗi kim loại trong hỗn hợp. c. Tính khối lượng muối thu được sau phản ứng.
\(n_{SO2}=\dfrac{8,4}{22,4}=0,375\left(mol\right)\)
Pt : \(Cu+2H_2SO_{4đặc}\underrightarrow{t^o}CuSO_4+SO_2+2H_2O|\)
1 2 1 1 2
a 0,15 1a
\(2Fe+6H_2SO_{4đặc}\underrightarrow{t^o}Fe_2\left(SO_4\right)_3+3SO_2+6H_2O|\)
2 6 1 3 6
b 0,075 1,5b
a) Gọi a là số mol của Cu
b là số mol của Fe
\(m_{Cu}+m_{Fe}=18\left(g\right)\)
⇒ \(n_{Cu}.M_{Cu}+n_{Fe}.M_{Fe}=18g\)
⇒ 64a + 56b = 18g (1)
Theo phương trình : 1a + 1,5b = 0,375(2)
Từ(1),(2), ta có hệ phương trình :
64a + 56b = 18g
1a + 1,5b = 0,375
⇒ \(\left\{{}\begin{matrix}a=0,15\\b=0,15\end{matrix}\right.\)
\(m_{Cu}=0,15.64=9,6\left(g\right)\)
\(m_{Fe}=0,15.56=8,4\left(g\right)\)
b) 0/0Cu = \(\dfrac{9,.6.100}{18}=53,33\)0/0
0/0Fe = \(\dfrac{8,4.100}{18}=46,67\)0/0
c) Có : \(n_{Cu}=0,15\left(mol\right)\Rightarrow n_{CuSO4}=0,15\left(mol\right)\)
\(n_{Fe}=0,15\left(mol\right)\Rightarrow n_{Fe2\left(SO4\right)3}=0,075\left(mol\right)\)
\(m_{CuSO4}=0,15.160=24\left(g\right)\)
\(m_{Fe2\left(SO4\right)3}=0,075.400=30\left(g\right)\)
Chúc bạn học tốt
Đúng 3
Bình luận (0)
Cho 17,2 gam hỗn hợp kim loại gồm Fe cà Cu tác dụng vừa đủ với dd H2SO4 đặc nóng dư thu được 6,72 lít khí SO2 (đktc) là sản phẩm khử duy nhất. Tính khối lượng mỗi muối và khối lượng dung dịch H2SO4 80% phản ứng
`2Fe + 6H_2 SO_[4(đ,n)] -> Fe_2(SO_4)_3 + 3SO_2 \uparrow + 6H_2 O`
`0,05` `0,15` `0,025` `(mol)`
`Cu + 2H_2 SO_[4(đ,n)] -> CuSO_4 + SO_2 \uparrow + 2H_2 O`
`0,225` `0,45` `0,225` `(mol)`
`n_[SO_2]=[6,72]/[22,4]=0,3(mol)`
Gọi `n_[Fe]=x` ; `n_[Cu]=y`
`=>` $\begin{cases} \dfrac{3}{2}x+y=0,3\\56x+64y=17,2 \end{cases}$
`<=>` $\begin{cases}x=0,05\\y=0,225 \end{cases}$
`@m_[Fe_2(SO_4)_3]=0,025.400=10(g)`
`@m_[CuSO_4]=0,225.160=36(g)`
`@m_[dd H_2 SO_4]=[(0,15+0,45).98]/80 .100=73,5(g)`
Đúng 4
Bình luận (0)
Sửa đề: 80% ---> 98% (80% chưa đặc nên không giải phóng SO2 được)
Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Cu}=b\left(mol\right)\end{matrix}\right.\)
\(\rightarrow56a+64b=17,2\left(1\right)\)
PTHH:
\(2Fe+6H_2SO_{4\left(đặc,nóng\right)}\rightarrow Fe_2\left(SO_4\right)_3+3SO_2\uparrow+6H_2O\)
a------>3a------------------->0,5a--------------->1,5a
\(Cu+2H_2SO_{4\left(đặc,nóng\right)}\rightarrow CuSO_4+SO_2\uparrow+2H_2O\)
b----->2b------------------->b------------->b
\(\rightarrow1,5a+b=\dfrac{6,72}{22,4}=0,3\left(2\right)\)
Từ \(\left(1\right)\left(2\right)\rightarrow\left\{{}\begin{matrix}a=0,05\left(mol\right)\\b=0,225\left(mol\right)\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}m_{Fe_2\left(SO_4\right)_3}=0,5.0,05.400=10\left(g\right)\\m_{CuSO_4}=0,225.160=36\left(g\right)\\m_{ddH_2SO_4}=\dfrac{\left(0,05.3+0,225.2\right).98}{98\%}=60\left(g\right)\end{matrix}\right.\)
Đúng 2
Bình luận (0)
Câu 1: Hòa tan hoàn toàn 18,4g hỗn hợp Zn và Al bằng dd H2SO4 dư thu được 11,2 lít khí SO2 (đktc). Tính thành phần phần % khối lượng mỗi kim loại trong hỗn hợp?
Câu 2:Cho 13,4g hỗn hợp Fe, Cu vào dd H2SO4 đặc nóng thu được 6,44 lít SO2 (đktc). Tính thành phần phần % khối lượng mỗi kim loại trong hỗn hợp?
Câu 3; Cho 4,48 lít khí SO2 (đktc) vào 200ml dd NaOH 1,6M. Tính nồng độ mol/l các chất trong dd sau phản ứng?
Đọc tiếp
Câu 1: Hòa tan hoàn toàn 18,4g hỗn hợp Zn và Al bằng dd H2SO4 dư thu được 11,2 lít khí SO2 (đktc). Tính thành phần phần % khối lượng mỗi kim loại trong hỗn hợp?
Câu 2:Cho 13,4g hỗn hợp Fe, Cu vào dd H2SO4 đặc nóng thu được 6,44 lít SO2 (đktc). Tính thành phần phần % khối lượng mỗi kim loại trong hỗn hợp?
Câu 3; Cho 4,48 lít khí SO2 (đktc) vào 200ml dd NaOH 1,6M. Tính nồng độ mol/l các chất trong dd sau phản ứng?
cho 6.05g hỗn hợp kim loại Fe Zn tác dụng với dd H2SO4 đặc nóng thu được 2.8 lít khí SO2(đktc). xác định % khối lượng mỗi kim loại trong hỗn hợp. mọi ng giúp em giải câu này với ạ
gọi x và y lần lượt là số mol của Fe và Zn ( x không âm)
\(2Fe+6H_2SO_{4\left(đ,n\right)}\rightarrow Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
x-------> 3x------------> 0,5x------------>1,5x------>3x
\(Zn+2H_2SO_{4\left(đ,n\right)}\rightarrow ZnSO_4+SO_2+2H_2O\)
y------->2y---------------->y-------->y------>2y
\(nSO_2=\dfrac{2,8}{22,4}=0,125\left(mol\right)\)
\(\left\{{}\begin{matrix}56x+65y=6,05\\1,5x+y=0,125\end{matrix}\right.\)
=> x = 0,05 ; y = 0,05
=> \(m_{Fe}=0,05.56=2,8\left(g\right)\)
=> \(\%m_{Fe}=\dfrac{2,8.100}{6,05}=46,28\%\)
=> \(\%m_{Zn}=100\%-46,28\%=53,72\%\)
Đúng 5
Bình luận (1)
Hoà tan hoàn toàn 13,6 gam hh A gồm Fe và Mg vào dd H2SO4 đặc, nóng 98% thu được dd X 8,96 lít khí SO2 (đktc).
a. Xác định thành phần % về khối lượng mỗi kim loại trong hỗn hợp ?
b. Tính nồng độ % các chất trong dd X .
#_giải chi tiết giùm nha mn_#
Cho 12 gam hỗn hợp gồm Cu và Fe tác dụng hoàn toàn với dung dịch H2SO4 đặc, nóng dư thu được 5,6 lít khí SO2 đktc ?a. Viết phương trình phản ứng xảy ra ?b. Tính phần trăm khối lượng mỗi kim loại trong hỗn hợp đầu ?c. Tính khối lượng muối thu được sau phản ứng ?d. Tính thể tích H2SO4 2M cần dùng ?
Đọc tiếp
Cho 12 gam hỗn hợp gồm Cu và Fe tác dụng hoàn toàn với dung dịch H2SO4 đặc, nóng dư thu được 5,6 lít khí SO2 đktc ?
a. Viết phương trình phản ứng xảy ra ?
b. Tính phần trăm khối lượng mỗi kim loại trong hỗn hợp đầu ?
c. Tính khối lượng muối thu được sau phản ứng ?
d. Tính thể tích H2SO4 2M cần dùng ?
a)
$Cu + 2H_2SO_4 \to CuSO_4 + SO_2 + H_2O$
$2Fe + 6H_2SO_4 \to Fe_2(SO_4)_3 + 3SO_2 + 6H_2O$
b) n Cu =a (mol) ; n Fe = b(mol)
=> 64a + 56b = 12(1)
n SO2 = a + 1,5b = 5,6/22,4 = 0,25(2)
(1)(2) suy ra a = b = 0,1
%m Cu = 0,1.64/12 .100% = 53,33%
%m Fe = 100% -53,33% = 46,67%
c)
n CuSO4 = a = 0,1(mol)
n Fe2(SO4)3 = 0,5a = 0,05(mol)
m muối = 0,1.160 + 0,05.400 = 36(gam)
d) n H2SO4 = 2n SO2 = 0,5(mol)
V H2SO4 = 0,5/2 = 0,25(lít)
Đúng 2
Bình luận (1)
Cho 2,14g hỗn hợp X gồm Zn, Fe phản ứng với dd axit sunfuric loãng dư thu được 784 ml khí (đktc). a. Tính thành phần phần trăm khối lượng mỗi kim loại trong hỗn hợp. b. Nếu cho 2,14g hỗn hợp X trên tác dụng với dd axit sunfuric đặc, nóng dư thì thu được bao nhiêu lít khi sunfuro (đktc)
\(n_{H_2}=\dfrac{0,784}{22,4}=0,035\left(mol\right)\)
Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Zn}=b\left(mol\right)\end{matrix}\right.\)
PTHH:
Fe + H2SO4 ---> FeSO4 + H2
a------------------------------>a
Zn + H2SO4 ---> ZnSO4 + H2
b---------------------------->b
\(\Rightarrow\left\{{}\begin{matrix}56a+65b=2,14\\a+b=0,035\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,015\left(mol\right)\\b=0,2\left(mol\right)\end{matrix}\right.\)
PTHH:
2Fe + 6H2SO4(đ, n) ---> Fe2(SO4)3 + 3SO2 + 6H2O
0,015--------------------------------------->0,0225
Zn + 2H2SO4(đ, n) ---> ZnSO4 + SO2 + 2H2O
0,02---------------------------------->0,02
=> VSO2 = (0,0225 + 0,02).22,4 = 0,952 (l)
Đúng 1
Bình luận (0)