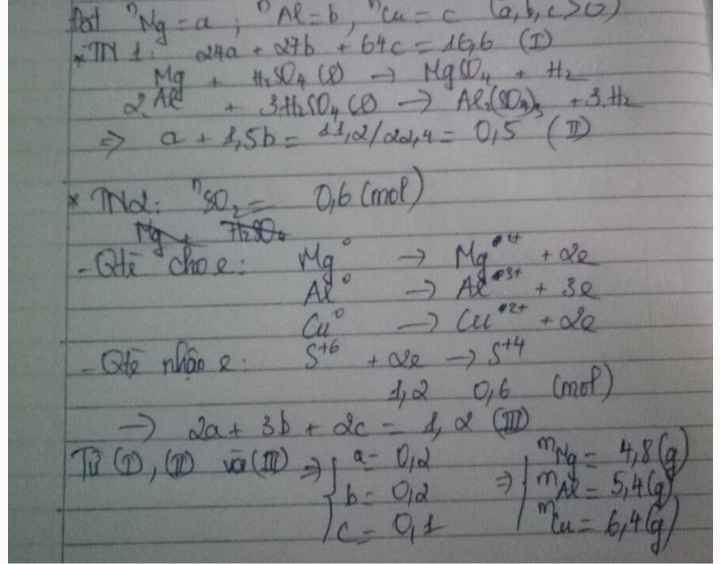Cho m gam Al tác dụng hết vs dd H2SO4 loãng dư thu đc 3,42g muối .tính thể tích dd h2so4 0,04M cần dùng,biết đã lấy dư 100ml?

Những câu hỏi liên quan
Cho a gam hh Al và Fe tác dụng hết vs dd H2SO4 loãng, vừa đủ , giải phóng 2,464 lít khí và dd Y có chứa 14,44g muối
A)tính khối lượng mỗi kim loại
B) dd Y tác dụng dd BaCl2 dư thu x gam kết tủa, còn nếu cho tác dụng vs dd NaOH vừa đủ tạo b gam kết tỉa .tính giá trị x,b=?
\(n_{H_2}=\dfrac{2,464}{22,4}=0,11mol\)
\(\left\{{}\begin{matrix}Al:x\left(mol\right)\\Fe:y\left(mol\right)\end{matrix}\right.\Rightarrow Muối\left\{{}\begin{matrix}Al_2\left(SO_4\right)_3\\FeSO_4\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}BTe:3x+2y=2n_{H_2}=0,22\\\dfrac{x}{2}\cdot342+y\cdot152=14,44\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,04mol\\y=0,05mol\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Al}=0,04\cdot27=1,08g\\m_{Fe}=0,05\cdot56=2,8g\end{matrix}\right.\)
\(Al_2\left(SO_4\right)_3+3BaCl_2\rightarrow2AlCl_3+3BaSO_4\downarrow\)
0,02 0,06
\(FeSO_4+BaCl_2\rightarrow BaSO_4\downarrow+FeCl_2\)
0,05 0,05
\(\Rightarrow\Sigma n_{\downarrow}=0,06+0,05=0,11\Rightarrow m_{BaSO_4}=x=25,63g\)
Đúng 1
Bình luận (0)
Tính thể tích khí H2 (dktc)thu được khí cho 5.4 gam Al tác dụng với a.Dd H2SO4 loãng dư b.400ml dd H2SO4 1M
\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\\ a.2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ n_{H_2}=\dfrac{3}{2}.0,2=0,3\left(mol\right)\\ V_{H_2\left(đktc\right)}=0,3.22,4=6,72\left(l\right)\\ b.n_{H_2SO_4}=0,4.1=0,4\left(mol\right)\\ 2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ Vì:\dfrac{0,2}{2}< \dfrac{0,4}{3}\\ \Rightarrow H_2SO_4dư\\ \Rightarrow n_{H_2}=\dfrac{3}{2}.0,2=0,3\left(mol\right)\\ V_{H_2\left(đktc\right)}=0,3.22,4=6,72\left(l\right)\)
Đúng 1
Bình luận (0)
\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
a) Pt : \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2|\)
2 3 1 3
0,2 0,3
\(n_{H2}=\dfrac{0,2.3}{2}=0,3\left(mol\right)\)
\(V_{H2\left(dktc\right)}=0,3.22,4=6,72\left(l\right)\)
b) 400ml = 0,4l
\(n_{H2SO4}=1.0,4=0,4\left(mol\right)\)
Pt : \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2|\)
2 3 1 3
0,2 0,4 0,3
Lập tỉ số so sánh : \(\dfrac{0,2}{2}< \dfrac{0,4}{3}\)
⇒ Al phản ứng hết , H2SO4 dư
⇒ Tính toán dựa vào số mol của Al
\(n_{H2}=\dfrac{0,2.3}{2}=0,3\left(mol\right)\)
\(V_{H2\left(dktc\right)}=0,3.22,4=6,72\left(l\right)\)
Chúc bạn học tốt
Đúng 1
Bình luận (0)
a)
$n_{Al} = \dfrac{5,4}{27} = 0,2(mol)$
$2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2$
Theo PTHH :
$n_{H_2} = \dfrac{3}{2}n_{Al} = 0,3(mol)$
$V_{H_2} = 0,3.22,4 = 6,72(lít)$
b)
$n_{H_2SO_4} = 0,4(mol)$
Ta thấy : $n_{Al} : 2 < n_{H_2SO_4} : 3$ nên $H_2SO_4$ dư
$V_{H_2} = 6,72(lít)$
Đúng 2
Bình luận (0)
Cho 0,8 g NaOH tác dụng với dd H2SO4 dư
a.Cô cạn dd sau pư thu đc bao nhiêu gam muối khan
a.Nếu lượng H2SO4 lấy dư 15% so với lượng phản ứng thì khối lượng H2SO4 đã dùng là bao nhiêu
\(n_{NaOH}=\dfrac{0,8}{40}=0,02mol\\ 2NaOH+H_2SO_4->Na_2SO_4+2H_2O\\ m_{Na_2SO_4}=142\cdot0,01=1,42g\\ n_{H_2SO_4pư}=0,01mol\\ m_{H_2SO_4}=98\cdot1,15\cdot0,01=1,127g\)
Đúng 2
Bình luận (0)
\(a.n_{NaOH}=\dfrac{0,8}{40}=0,02\left(mol\right)\\2 NaOH+H_2SO_4\xrightarrow[]{}Na_2SO_4+2H_2O\\ \Rightarrow n_{Na_2SO_4}=\dfrac{1}{2}0,02=0,01\left(mol\right)\\ m_{Na_2SO_4}=0,01.142=1,42\left(g\right)\\ b.n_{H_2SO_4\left(pư\right)}=\dfrac{1}{2}0,02=0,01\left(mol\right)\\ n_{H_2SO_4\left(dư\right)}=0,01.15\%=0,0015\left(mol\right)\\ m_{H_2SO_4\left(dùng\right)}=\left(0,01+0,0015\right).98=1,127\left(g\right)\)
Đúng 0
Bình luận (0)
Cho 5,4g Nhôm tác dụng vs 245g dd H2SO4 20% a) Chất nào dư? Bao nhiêu gam? b) Tính thể tích khí H2 thu đc ở đktc c) Tính C% của muối trong dd thu được
\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right);n_{H_2SO_4}=\dfrac{245.20\%}{98}=0,5\left(mol\right)\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
0,2..........0,5
Lập tỉ lệ : \(\dfrac{0,2}{2}< \dfrac{0,5}{3}\)
=> H2SO4 dư
\(n_{H_2}=\dfrac{3}{2}n_{Al}=0,3\left(mol\right)\)
=> V H2 = 0,3.22,4= 6,72(l)
\(m_{ddsaupu}=5,4+245-0,3.2=249,8\left(g\right)\)
=> \(C\%_{Al_2\left(SO_4\right)_3}=\dfrac{0,1.342}{249,8}.100=13,69\%\)
Đúng 2
Bình luận (0)
a) mH2SO4=20%.245=49(g) ->nH2SO4=49/98=0,5(mol)
nAl=5,4/27=0,2(mol)
PTHH: 2Al +3 H2SO4 -> Al2(SO4)3 +3 H2
Ta có: 0,2/2 < 0,5/3
=> H2SO4 dư, Al hết, tính theo nAl
=> nH2SO4(p.ứ)=nH2=3/2. nAl=3/2. 0,2= 0,3(mol)
=> nH2SO4(dư)=0,5 - 0,3=0,2(mol)
=>mH2SO4(dư)=0,2.98=19,6(g)
b) V(H2,đktc)=0,3.22,4=6,72(l)
c) nAl2(SO4)3= 1/2. nAl=1/2. 0,2=0,1(mol)
=>mAl2(SO4)3=342.0,1=34,2(g)
mddAl2(SO4)3=mAl+ mddH2SO4-mH2=5,4+245 - 0,3.2= 249,8(g)
=>C%ddAl2(SO4)3= (34,2/249,8).100=13,691%
Đúng 1
Bình luận (0)
1.cho 4 8g mg tác dụng vừa đủ với m gam dd hcl 14,6%
a. tính giá trị m và thể tích hidro
b C% muối thu đc
2. cho 13g zn tác dụng vừa đủ vs 200g dd H2SO4
a tính C% đ h2so4 đã dùng
b tính c% dd muối thu đc
mik đg cần gấp mai nộp ai nhanh nhất mik đánh dấu cho nha mãi iuu
): Hòa tan hoàn toàn m gam sắt (III) oxit bằng dd H2SO4 loãng 19,6 % (vừa đủ). Sau khi phản ứng kết thúc, thu được dd muối X. Cho toàn bộ lượng X tác dụng hết với dd BaCl2 dư thì thu được 34,95 gam kết tủa. Tính m và khối lượng dd H2SO4
Đọc tiếp
): Hòa tan hoàn toàn m gam sắt (III) oxit bằng dd H2SO4 loãng 19,6 % (vừa đủ). Sau khi phản ứng kết thúc, thu được dd muối X. Cho toàn bộ lượng X tác dụng hết với dd BaCl2 dư thì thu được 34,95 gam kết tủa. Tính m và khối lượng dd H2SO4
Cho m gam hỗn hợp (Al,Fe,Cu) tác dụng vs dd H2SO4 đặc, nguội lấy dư .sau phản ứng thu đc V lít khí SO2 đktc mặt khác nếu cũng cho m gam hh trên tác dụng vs HCl dư , sau phản ứng thu đc 6,4g chất rắn ko tan.giá trị của V?
Al, Fe không tác dụng với H2SO4 đặc nguội
Rắn không tan ở TN2 là Cu
mCu = 6,4 (g)
=> \(n_{Cu}=\dfrac{6,4}{64}=0,1\left(mol\right)\)
PTHH: Cu + 2H2SO4 --> CuSO4 + SO2 + 2H2O
0,1-------------------------->0,1
=> V = 0,1.22,4 = 2,24 (l)
Đúng 3
Bình luận (0)
Cho 16,6 gam hh X gồm Al,Cu,Mg tác dụng vs H2SO4 loãng dưthu đc 11,2 lít khí .còn nếu cho 16,6g hỗn hợp trên tác dụng vs dd H2SO4 đặc,to dư thì giải phóng 13,44 lít khí .Tính khối lượng mỗi kim loại
Cho 12,8 hh bột Magie và Magie oxit tác dụng với dd H2SO4 1M (dư) làm thoát ra 10,08 l khí (đktc). Tính thể tích dd H2SO4 đã dùng, biết lấy dư 5% so với phản ứng.
$Mg + H_2SO_4 \to MgSO_4 + H_2$
$MgO + H_2SO_4 \to MgSO_4 + H_2O$
$n_{Mg} = n_{H_2} = \dfrac{10,08}{22,4} = 0,45(mol)$
$\Rightarrow n_{MgO} = \dfrac{12,8 - 0,45.24}{40} = 0,05(mol)$
$n_{H_2SO_4\ pư} = n_{Mg} + n_{MgO} = 0,5(mol)$
$n_{H_2SO_4\ dư} = 0,5.5\% = 0,025(mol)$
$\Rightarrow V_{dd\ H_2SO_4} = \dfrac{0,5 + 0,025}{1} = 0,525(lít)$
Đúng 4
Bình luận (0)