tính thể tích H₂ và thể tích O₂ (đktc) cần tác dụng với nhau để tạo ra được 9g H₂O

Những câu hỏi liên quan
Tính thể tích khí hiđro và oxi(đktc) cần tác dụng với nhau để tạo ra được 1,8g nước.
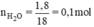
Phương trình phản ứng:
2H2 + O2 → 2H2O.
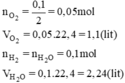
Đúng 0
Bình luận (0)
Tính thể tích khí hidro và khí oxi (ở đktc) cần tác dụng với nhau để tạo ra 1,8 gam nước.
Tính thể tích khí hiđro (ở đktc) cần tác dụng với nhau để tạo ra đc 1,8 gam nước
\(n_{H_2o}=\dfrac{1,8}{18}=0,1\left(mol\right)\\
pthh:2H_2+O_2\underrightarrow{t^o}2H_2O\)
0,1 0,1
\(V_{H_2}=0,1.22,4=2,24\left(l\right)\)
Đúng 4
Bình luận (0)
\(n_{H_2O}=\dfrac{1,8}{18}=0,1\left(mol\right)\)
PTHH: \(2H_2+O_2\underrightarrow{t^o}2H_2O\)
0,1<--0,05<--0,1
\(\rightarrow\left\{{}\begin{matrix}V_{O_2}=0,05.22,4=1,12\left(l\right)\\V_{H_2}=0,1.22,4=2,24\left(l\right)\end{matrix}\right.\)
Đúng 3
Bình luận (0)
Cho 19,5 g kẽm tác dụng với dung dịch axit HCl . Hãy cho biết : a) Thể tích khí H² sinh ra (đktc) . b) Nếu dùng thể tích khí H² trên để khử 19,2g Fe²O³ thì thu được bao nhiêu g sắt. ( Biết P=31, O=16, H=1, S=32, Zn=65, Fe=56 )
a.\(n_{Zn}=\dfrac{19,5}{65}=0,3mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,3 0,3 ( mol )
\(V_{H_2}=0,3.22,4=6,72l\)
b.\(n_{Fe_2O_3}=\dfrac{19,2}{160}=0,12mol\)
\(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
Xét: \(\dfrac{0,12}{1}\) > \(\dfrac{0,3}{3}\) ( mol )
0,3 0,2 ( mol )
\(m_{Fe}=0,2.56=11,2g\)
Đúng 8
Bình luận (0)
Cho 3,9g Kali (K) tác dụng với nước, sau phản ứng thu được kali hiđroxit (KOH) và khí hiđro (H2).
a. Viết phương trình hóa học
b. Tính khối lượng kali hiđroxit (KOH) tạo thành
c. Tính thể tích hiđro (H2) sinh ra ở đktc
(K=39, H=1, O=16)
\(n_K=\dfrac{3,9}{39}=0,1mol\)
\(2K+2H_2O\rightarrow2KOH+H_2\)
0,1 0,1 0,05 ( mol )
\(m_{KOH}=0,1.56=5,6g\)
\(V_{H_2}=0,05.22,4=1,12l\)
Đúng 4
Bình luận (1)
2K+2H2O->2KOH+H2
0,1-----------------0,1---0,05
n K=0,1 mol
=>m KOH=0,1.56=5,6g
VH2=0,05.22,4=1,12l
Đúng 2
Bình luận (1)
Tính thể tích khí Hiđro và khí Oxi (ở đktc) cần tác dụng với nhau để tạo ra 5,4g nước.
- giúp mình với cần gấp trong đêm nay !!!
Số mol nước tạo thành là:
nH2OnH2O = 1,8/18 = 0,1 (mol)
Phương trình phản ứng:
2H2 + O2 → 2H2O
2 mol 1 mol 2 mol
0,1 mol 0,05 mol 0,1 mol
Thể tích khí hidro tham gia phản ứng:
V = 22,4 x 0,1 = 2,24 (lít)
Thể tích khí oxi tham gia phản ứng:
V = 22,4 x 0,05 = 1,12 (lít)
- cái này là Hóa 8 mà sao cho dzô thể loại toán 7 vậy má =))
Tính thế tích khí hiđro và oxi ( ở đktc) cần tác dụng với nhau để tạo ra được 3,6 gam nước
\(PTHH:2H_2+O_2\rightarrow2H_2O\)
Số mol của 3,6 gam nc là:
\(n_{H_2O}=\dfrac{m}{M}=\dfrac{3,6}{18}=0,2\left(mol\right)\)
Thể tích khí Oxi là:
\(V_{O_2}=n.22,4=0,1.22,4=2,24\left(l\right)\)
Thể tích khí hidro là:
\(V_{H_2}=n.22,4=0,2.22,4=4,48\left(l\right)\)
Đúng 2
Bình luận (0)
\(n_{H_2O}=\dfrac{3,6}{18}=0,2\left(m\right)\)
\(PTHH:2H_2+O_2->2H_2O\)
tỉ lệ :2 1 2
số mol :0,2 0,1 0,2
\(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
\(V_{O_2}=0,1.22,4=2,24\left(l\right)\)
Đúng 1
Bình luận (0)
Tính thể tích khí hidro và oxi (dktc) cần tác dụng với nhau để tạo ra 7,2 gam nước
nH2O = 7,2/18 = 0,4 mol
2H2 + O2 ➝ 2H2O
0,4 0,2 0,4 (mol)
VH2 = 0,4.22,4 = 8,96 lít
VO2 = 0,2.22,4 = 4,48 lít
Đúng 2
Bình luận (0)
Có 6,5g Zn tác dụng với dung dịch H2SO4 loãng a) Viết phương trình phản ứng b) thể tích của chất khí thoát ra ở đktc c) tính khối lượng của muối tạo thành phản ứng sau ( Cho biết H=1, Zn =65,S=39,O=16) Mình đang cần gấp
a) \(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
PTHH:
Zn + H2SO4(l) ---> ZnSO4 + H2
0,1------------------>0,1------>0,1
b) VH2 = 0,1.24,79 = 2,479 (l)
c) mZnSO4 = 0,1.136 = 13,6 (g)
Đúng 1
Bình luận (0)
























