Cần bao nhiêu gam NaOH để pha chế 300,0 ml dung dịch có pH = 10,0?

Những câu hỏi liên quan
Cần bao nhiêu gam NaOH để pha chế 250 ml dung dịch có pH = 10 ?
Khi pH = 10 thì [H+] = 1.10-10M và
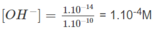
nghĩa là cần có 1. 10 - 4 mol NaOH trong 1 lít dung dịch.
Vậy trong 250 ml (0,25 lít) dung dịch cần có 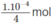 NaOH hoà tan, nghĩa là cần có
NaOH hoà tan, nghĩa là cần có
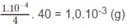 NaOH
NaOH
Đúng 0
Bình luận (0)
Khối lượng NaOH cần dùng để pha chế 250,0 ml dung dịch có pH = 10,0 là
Ta có: \(pH=14+log\left(OH^-\right)\) \(\Rightarrow log\left(OH^-\right)=-4\)
\(\Rightarrow\left[OH^-\right]=C_{M_{NaOH}}=0,0001\left(M\right)\)
\(\Rightarrow n_{NaOH}=0,0001\cdot0,25=2,5\cdot10^{-5}\left(mol\right)\)
\(\Rightarrow m_{NaOH}=2,5\cdot10^{-5}\cdot40=0,001\left(g\right)\)
Đúng 1
Bình luận (0)
Cần bao nhiêu gam HCl để pha chế 400 ml dung dịch có pH=2?
A. 0,146 gam
B. 0,292 gam
C. 0,438 gam
D. 0,219 gam
Đáp án A
nHCl= nH+= 0,4.10-2 (mol), mHCl= 0,146 gam
Đúng 0
Bình luận (0)
Cần dùng bao nhiêu ml dung dịch NaOH 3% có khối lượng riêng là 1,05g/ml và bao nhiêu mililit dung dịch NaOH 10% có khối lượng riêng là 1,12g/ml để pha chế được 2 lit dung dịch NaOH 8% có khối lượng riêng là 1,10g/ml.
* Phần tính toán:
Khối lượng dung dịch NaOH: m d d = D.V = 1,1.2000=2200(g)
Khối lượng NaOH có trong 2 lit dung dịch:
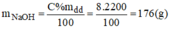
Gọi x(ml) là thể tích của dung dịch NaOH 3% ⇒ m d d = V.d = 1,05.x
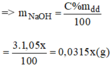
Gọi y(ml) là thể tích của dung dịch NaOH 10% ⇒ m d d = V.d = 1,12.y
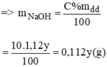
Ta có hệ phương trình sau: 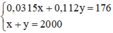
Giải hệ phương trình trên, ta được: 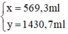
* Cách pha chế:
Đong lấy 569,3ml dung dịch NaOH 3% và 1430,7ml dung dịch NaOH 10% vào bình có dung dịch khoảng 3 lit. Trộn đều ta được 2 lit dung dịch NaOH 8% có khối lượng riêng 1,1g/ml.
Đúng 0
Bình luận (0)
Để pha chế 250ml dung dịch NaOH 0,5M cần bao nhiêu ml dung dịch NaOH 2M và bao nhiêu ml nước?
Help me please!!!!
Theo đề bài ta có
Số mol của NaOH hòa tan trong 250 ml dd NaOH 0,5M là
nNaOH=CM.V=0,5.0,25=0,125 mol
⇒⇒ Thể tích dung dịch NaOH 2M trong đó có chứa 0,125 mol NaOH là
\(v=\frac{n}{CM}=\frac{0,125}{2}=0,0625l=6,25ml\)
Đúng 0
Bình luận (0)
Theo đề bài ta có:
Số mol của NaOH hòa tan trong 250 ml dd NaOH 0,5M là
nNaOH=CM.V=0,5.0,25=0,125 mol
⇒ Thể tích dung dịch NaOH 2M trong đó có chứa 0,125 mol NaOH là
V=\(\frac{n}{CM}\)=\(\frac{0,125}{2}\)= 0,0625l = 6,25ml
Đúng 0
Bình luận (1)
Cần bao nhiêu gam NaOH để pha được 500 ml dung dịch có pH = 12? A. 0,4 g B. 0,1 gC. 0,3 g D. 0,2 g
pH=12 => 14 + log[OH-]=12
<=>[OH-]=0,01
=> nNaOH=nOH- = 0,5. 0,01= 0,005(mol)
=> mNaOH=0,005.40=0,2(g)
=> CHỌN D
Chúc em học tốt!
Đúng 2
Bình luận (0)
Câu 2: Trộn 200 ml dung dịch HCl 1M với 300 ml dung dịch HCl 1,5 M thu được dung dịch HCl có nồng độ mol/lit là bao nhiêu?
Câu 3: Cần thêm bao nhiêu ml H2O (D = 1 g/ml) vào 100 gam dung dịch NaOH 35% để thu được dung dịch NaOH 20%.
Câu 4: Cần pha bao nhiêu lít dung dịch HCl 2M với bao nhiêu lít dung dịch HCl 3M để thu được 4 lít dung dịch HCl 2,75M.
Câu 2 :
$n_{HCl} = 0,2.1 + 0,3.1,5 = 0,65(mol)$
$V_{dd} = 0,2 + 0,3 = 0,5(mol)$
$C_{M_{HCl}} = \dfrac{0,65}{0,5} =1,3M$
Câu 3 :
Gọi $m_{H_2O\ cần\ thêm} =a (gam)$
Sau khi thêm :
$m_{NaOH} = 100.35\% = 35(gam)$
$m_{dd} = 100 + a(gam)$
Suy ra: $\dfrac{35}{100 + a}.100\% = 20\%$
Suy ra: a = 75(gam)
Câu 4 :
Gọi $V_{dd\ HCl\ 2M} =a (lít) ; V_{dd\ HCl\ 3M} = b(lít)$
Ta có :
$a + b = 4$
$2a + 3b = 4.2,75$
Suy ra a = 1(lít) ; b = 3(lít)
Đúng 2
Bình luận (0)
Cần bao nhiêu gam NaOH và bao nhiêu lít dung dịch NaOH 0,4M để pha chế được 2 lít dung dịch NaOH 2M (D = 1,05 g/ml). Biết D H2O = 1g/ml
Câu 3: Cần thêm bao nhiêu ml H2O (D = 1 g/ml) vào 100 gam dung dịch NaOH 35% để thu được dung dịch NaOH 20%. Câu 4: Cần pha bao nhiêu lít dung dịch HCl 2M với bao nhiêu lít dung dịch HCl 3M để thu được 4 lít dung dịch HCl 2,75M.
\(m_{NaOH\left(35\%\right)}=100.35\%=35\left(g\right)\)
\(m_{ddNaOH\left(20\%\right)}=\dfrac{35}{20}.100=175\left(g\right)\)
⇒ mnước thêm vào = 175-100 = 75(g)
Vnước thêm vào = 75.1 = 75 (ml)
Đúng 1
Bình luận (1)
Câu 4:
\(n_{HCl}=4.2,75=11\left(mol\right)\)
Ta có: \(V_{ddHCl\left(2M\right)}=\dfrac{n_{HCl\left(1\right)}}{2}\left(l\right);V_{ddHCl\left(3M\right)}=\dfrac{n_{HCl\left(2\right)}}{3}\left(l\right)\)
\(\Rightarrow V_{ddHCl\left(2M\right)}+V_{ddHCl\left(3M\right)}=\dfrac{n_{HCl\left(1\right)}}{2}+\dfrac{n_{HCl\left(2\right)}}{3}\)
\(\Leftrightarrow4=\dfrac{3n_{HCl\left(1\right)}+2n_{HCl\left(2\right)}}{6}\Leftrightarrow3n_{HCl\left(1\right)}+2n_{HCl\left(2\right)}=24\)
Ta có: \(\left\{{}\begin{matrix}n_{HCl\left(1\right)}+n_{HCl\left(2\right)}=11\\3n_{HCl\left(1\right)}+2n_{HCl\left(2\right)}=24\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}n_{HCl\left(1\right)}=2\\n_{HCl\left(2\right)}=9\end{matrix}\right.\)
\(\Rightarrow V_{ddHCl\left(2M\right)}=\dfrac{2}{2}=1\left(l\right);V_{ddHCl\left(3M\right)}=\dfrac{9}{3}=3\left(l\right)\)
Đúng 1
Bình luận (0)
Câu 3:
\(m_{NaOH}=35.100\%=35\left(g\right)\\ m_{H_2O\left(thêm\right)}=a\left(g\right)\\ \Rightarrow\dfrac{35}{100+a}.100\%=20\%\\ \Leftrightarrow a=75\left(g\right)\\ \Rightarrow V_{H_2O\left(thêm\right)}=\dfrac{75}{1}=75\left(ml\right)\)
Câu 4:
\(Đặt:V_{ddHCl\left(pha.thêm2M\right)}=a\left(l\right)\\ V_{ddHCl\left(pha.thêm3M\right)}=b\left(l\right)\\ \Rightarrow\dfrac{2a+3b}{a+b}=2,75\left(1\right)\\ Mà:a+b=4\left(2\right)\\ Từ\left(1\right),\left(2\right)\Rightarrow\left\{{}\begin{matrix}a=1\left(l\right)\\b=3\left(l\right)\end{matrix}\right.\)
Vậy cần pha 1 lít dung dịch HCl 2M vào 3 lít dung dịch HCl 3M để thu được 4 lít dung dịch HCl 2,75M
Chúc em học tốt!
Đúng 1
Bình luận (0)




















