Tính khối lượng mol của khí A . Biết khí A nặng hơn khí hiđro là 22 lần

Những câu hỏi liên quan
Biết khí A nặng hơn khí hriđo là 40 lần .
a . Tìm khối lượng mol của khí A ?
b. Khí A nặng hay nhẹ hơn không khí ?
a. dA/H2= 40 =>\(\dfrac{M^{_A}}{M_{H2}}\) = 40 => A = 80 g/mol
b. dA/kk = \(\dfrac{M^{_A}}{M_{H2}}\)= \(\dfrac{80}{29}\)= 2,76
Vậy: Khí A nặng hơn không khí 2,76 lần
Đúng 4
Bình luận (1)
Hãy tìm CT hóa học của khí A. biết rằng A) khí A nặng hơn khí hiđro 18, 25 lần B) thành phần theo khối lượng của khí A là 97, 26 % Clo và còn lại là hiđro
a) \(M_{H_2}=2\left(g/mol\right);d_{A/H_2}=\dfrac{M_A}{M_{H_2}}=18,25\)
=> \(M_A=2.18,25=36,5\left(g/mol\right)\)
b) \(\left\{{}\begin{matrix}n_{Cl}=\dfrac{36,5.97,26\%}{35,5}=1\left(mol\right)\\n_H=\dfrac{36,5-35,5}{1}=1\left(mol\right)\end{matrix}\right.\)
=> A: HCl
Đúng 0
Bình luận (0)
Hỗn hợp khí gồm (N2, O2) có tỉ lệ mol tương ứng là 1: 2. Tính khối lượng mol trung bình của hỗn hợp. Hỗn hợp khí đó nặng hơn khí hiđro bao nhiêu lần?
Hãy tìm công thức hoá học của khí A. Biết rằng : - khí A nặng hơn khí Hiđro 8, 5 lần - Thành phần theo khối lượng của khí A là 82,35%N và 17,65%H
\(d_{\dfrac{A}{H_2}}=8,5\\ M_{H_2}=2\left(\dfrac{g}{mol}\right)\\ \Rightarrow M_A=d_{\dfrac{A}{H_2}}.M_{H_2}=8,5.2=17\left(\dfrac{g}{mol}\right)\)
\(\Rightarrow m_N=\%N.M_A=82,35\%.17=14\left(g\right)\\ m_H=m_A-m_N=17-14=3\left(g\right)\\ \Rightarrow n_N=\dfrac{m}{M}=\dfrac{14}{14}=1\left(mol\right)\\ n_H=\dfrac{m}{M}=\dfrac{3}{1}=3\left(mol\right)\\ CTHH:NH_3\)
Đúng 2
Bình luận (1)
\(M_A=M_{H_2}.8,5=2.8,5=17(g/mol)\)
Đặt CTHH của \(A\) là \(N_xH_y\)
Ta có : \(\dfrac{14x.100}{17}=82,35\)
\(-> x=1\)
Ta có : \(\dfrac{y.100}{17}=17,65\)
\(->y=3\)
Vậy CTHH của \(A\) là \(NH_3\)
Đúng 1
Bình luận (3)
tính khối lượng mol của khí A. biết khí A nặng hơn khí H2 16 lần .
Ghi rõ cách trình bày & công thức & kết quả ạ .
\(d\dfrac{_{M_A}}{M_{H_2}}=16\Rightarrow M_A=16.2=32\left(\dfrac{g}{mol}\right)\)
=> Khối lượng mol của khí A là 32 g/mol
Đúng 3
Bình luận (0)
\(d_{\dfrac{A}{H_2}}=16\\ M_{H_2}=2\left(\dfrac{g}{mol}\right)\\ \Rightarrow M_A=d_{\dfrac{A}{H_2}}.M_{H_2}=16.2=32\left(\dfrac{g}{mol}\right)\)
Vậy khối lượng mol của khí A là 16 g/mol (mình nghi là khí metan CH4 lắm)
Đúng 0
Bình luận (1)
tính khối lượng mol của khí A. biết khí A nặng hơn khí H216 lần .
[ Ghi rõ công thức và câu trả lời chi tiết giùm e với ạ ]
\(d_{\dfrac{A}{H_2}}=\dfrac{M_A}{M_{H_2}}=\dfrac{M_A}{2}=16\left(lần\right)\)
\(\Leftrightarrow M_A=16.2=32\left(\dfrac{g}{mol}\right)\)
Đúng 1
Bình luận (1)
\(d_{\dfrac{MA}{MH_2}}=16\Rightarrow M_A=16.2=32\left(\dfrac{g}{mol}\right)\)
Đúng 0
Bình luận (0)
Hãy tìm công thức hóa học của khí A.
- Khí A nặng hơn khí hiđro 17 lần.
- Thành phần theo khối lượng của khí A là 5,88% H và 94,12% S.
Khối lượng mol của khí A : dA/H2 = 17 ⇒ MA = 17.2 = 34 (g)
Khối lượng mỗi nguyên tố có trong 1 mol khí A:
 mS = 34 – 2 = 32 (g)
mS = 34 – 2 = 32 (g)
Số mol nguyên tử mỗi nguyên tố trong 1 mol khí A có:
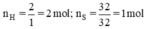
Vậy trong 1 mol phân tử chất A có : 2 nguyên tử H và 1 nguyên tử S
⇒ CTHH của khí A là H2S
Đúng 0
Bình luận (0)
Câu 5:1. Tìm khối lượng mol của khí X có tỉ khối đối với O2 là: 1,375; 0,0625.2. Tìm khối lượng mol của khí X có tỉ khối đối với không khí là: 2,207; 1,172.3. Tình công thức hóa học của khí X, biết khí X nặng hơn khí H2 17 lần.4. Hãy tính thể tích khí O2 đủ để đốt cháy hết 11,2 lít khí X. a. Biết rằng tỉ khối của X đối với không khí là 0,552. b. Thành phần theo khối lượng của khí X là: 75% C và 25% H
Đọc tiếp
Câu 5:
1. Tìm khối lượng mol của khí X có tỉ khối đối với O2 là: 1,375; 0,0625.
2. Tìm khối lượng mol của khí X có tỉ khối đối với không khí là: 2,207; 1,172.
3. Tình công thức hóa học của khí X, biết khí X nặng hơn khí H2 17 lần.
4. Hãy tính thể tích khí O2 đủ để đốt cháy hết 11,2 lít khí X. a. Biết rằng tỉ khối của X đối với không khí là 0,552. b. Thành phần theo khối lượng của khí X là: 75% C và 25% H
1)
$M_X = 1,375.32 = 44(g/mol)$
$M_X = 0,0625.32 = 2(g/mol)$
2)
$M_X = 2,207.29 = 64(g/mol)$
$M_X = 1,172.29 = 34(g/mol)$
3)
$M_X = 17.2 = 34(g/mol)$
Vậy khí X là $H_2S$
4)
a) $M_X = 0,552.29 = 16$
Gọi CTHH của X là $C_xH_y$
Ta có : $\dfrac{12x}{75} = \dfrac{y}{25} = \dfrac{16}{100}$
Suy ra: x = 1 ; y = 4
Vậy X là $CH_4$
$CH_4 + 2O_2 \xrightarrow{t^o} CO_ 2+ 2H_2O$
$V_{O_2} = 2V_{CH_4} = 11,2.2 = 22,4(lít)$
Đúng 2
Bình luận (0)
Cho khí X nặng hơn khí Y là 2 lần, biết khí Y nặng hơn không khí 1,1034 lần. Hãy xác định khối lượng mol của khí X và khí Y. Dự đoán X, Y là những khí gì?
\(d_{\dfrac{Y}{kk}}=1,1034\\ M_{kk}=29\left(\dfrac{g}{mol}\right)\\ M_Y=1,1034.29=32\left(\dfrac{g}{mol}\right)\\ \Rightarrow Y.có.thể.là.khí.O_2\)
\(d_{\dfrac{X}{Y}}=2\\ M_Y=32\left(\dfrac{g}{mol}\right)\\ M_X=2.32=64\left(\dfrac{g}{mol}\right)\\ \Rightarrow X.có.thể.là.khí.SO_2\)
Đúng 0
Bình luận (0)
Khí A nặng hơn khí Hiđro là 14 lần. thành phần theo khối lượng của khí A là 85,71% C và 14,29% H. Hãy xác định công thức hóa học của A
Xem chi tiết
MH2 = 2(g/mol) => MA = 14.2 = 28 (g/mol)
Gọi công thức hóa học của A là CxHy
%C trong A = \(\dfrac{12.x}{28}.100\) = 85,71 => x = 2
%H trong A = \(\dfrac{1.y}{28}.100\) = 14,29 => y = 4
Vậy CTHH của A là C2H4
Đúng 0
Bình luận (0)





















