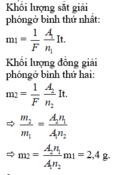Số nguyên tử đồng có trong 64 g đồng là: (Biết Cu = 64) *

Những câu hỏi liên quan
Số nguyên tử đồng có trong 64 gam đồng là: (Biết Cu 64) A.3.1023 B.9.1023 C.6.1023 D.12 .1023
Đọc tiếp
Số nguyên tử đồng có trong 64 gam đồng là: (Biết Cu = 64)
A.
3.1023
B.9.1023
C.6.1023
D.12 .1023
Hai bình điện phân: (
FeCl
3
/
Fe
và
CuSO
4
/
Cu
) mắc nối tiếp. Sau một khoảng thời gian, bình thứ nhất giải phóng một lượng sắt là 1,4 g. Tính lượng đồng giải phóng ở bình thứ hai trong cùng khoảng thời gian đó. Biết đồng có khối lượng mol nguyên tử là 64 g/mol, hoá trị 2 và sắt có khối lượng mol nguyên tử là 56 g/mol, hoá trị 3.
Đọc tiếp
Hai bình điện phân: ( FeCl 3 / Fe và CuSO 4 / Cu ) mắc nối tiếp. Sau một khoảng thời gian, bình thứ nhất giải phóng một lượng sắt là 1,4 g. Tính lượng đồng giải phóng ở bình thứ hai trong cùng khoảng thời gian đó. Biết đồng có khối lượng mol nguyên tử là 64 g/mol, hoá trị 2 và sắt có khối lượng mol nguyên tử là 56 g/mol, hoá trị 3.
Khối lượng sắt giải phóng ở bình thứ nhất: m 1 = 1 F . A 1 n 1 . I t
Khối lượng đồng giải phóng ở bình thứ hai: m 2 = 1 F . A 2 n 2 . I t
⇒ m 2 m 1 = A 2 . n 1 A 1 . n 2 ⇒ m 2 = A 2 . n 1 A 1 . n 2 . m 1 = 2 , 4 g
Đúng 0
Bình luận (0)
Hai bình điện phân: (
FeCl
3
/
Fe
và
CuSO
4
/
Cu
) mắc nối tiếp. Sau một khoảng thời gian, bình thứ nhất giải phóng một lượng sắt là 1,4 g. Tính lượng đồng giải phóng ở bình thứ hai trong cùng khoảng thời gian đó. Biết đồng có khối lượng mol nguyên tử là 64 g/mol, hoá trị 2 và sắt có khối lượng mol nguyên tử là 56 g/mol, hoá trị 3.
Đọc tiếp
Hai bình điện phân: ( FeCl 3 / Fe và CuSO 4 / Cu ) mắc nối tiếp. Sau một khoảng thời gian, bình thứ nhất giải phóng một lượng sắt là 1,4 g. Tính lượng đồng giải phóng ở bình thứ hai trong cùng khoảng thời gian đó. Biết đồng có khối lượng mol nguyên tử là 64 g/mol, hoá trị 2 và sắt có khối lượng mol nguyên tử là 56 g/mol, hoá trị 3.
Khối lượng sắt giải phóng ở bình thứ nhất: m 1 = 1 F . A 1 n 1 . I t
Khối lượng đồng giải phóng ở bình thứ hai: m 2 = 1 F . A 2 n 2 . I t
⇒ m 2 m 1 = A 2 . n 1 A 1 . n 2 ⇒ m 2 = A 2 . n 1 A 1 . n 2 . m 1 = 2 , 4 g
Đúng 0
Bình luận (0)
Bài 1: Biết nguyên tử khối của Ag là 107.88. Trong thiên nhiên Ag có 2 đồng vị 107Ag ( 56%). Tìm số khối đồng vị thứ 2- Nếu có 500 nguyên tử Ag thì có bao nhiêu nguyên tử của đồng vị 2- Tính khối lượng của đồng vị 107Ag trong 57.94g Ag2O ( cho O đồng vị là 16O )Bài 2: bài 7 Clo có các đồng vị 35Cl và 37Cl . Biết nguyên tử khối của Cl là 35.5a) Tính % các đồng vị b) tính % 37Cl trong CuCl2 ( Cu64 )c) tính số nguyên tử 35Cl có trong 13.35g AlCl3
Đọc tiếp
Bài 1: Biết nguyên tử khối của Ag là 107.88. Trong thiên nhiên Ag có 2 đồng vị 107Ag ( 56%). Tìm số khối đồng vị thứ 2
- Nếu có 500 nguyên tử Ag thì có bao nhiêu nguyên tử của đồng vị 2
- Tính khối lượng của đồng vị 107Ag trong 57.94g Ag2O ( cho O đồng vị là 16O )
Bài 2: bài 7 Clo có các đồng vị 35Cl và 37Cl . Biết nguyên tử khối của Cl là 35.5
a) Tính % các đồng vị
b) tính % 37Cl trong CuCl2 ( Cu=64 )
c) tính số nguyên tử 35Cl có trong 13.35g AlCl3
Bài 1:
Gọi x là số khối của đồng vị thứ 2, ta có:
\(\frac{107.56\%+x44\%}{100\%}=107,88\)
\(\Rightarrow x=109\)
Vậy số khối của đồng vị thứ 2 là 109
Nếu có 500 nguyên tử Ag thì số nguyên tử của đồng vị thứ 2 là: \(\frac{44\%.500}{100\%}=220\) (nguyên tử)
\(M_{Ag^{ }_2O}=\left(107,88.2\right)+16=231,76\)
\(\Rightarrow n=\frac{57,94}{231,76}=0,25\left(mol\right)\)
Xét trong 1 mol Ag2O có \(\begin{cases}2molAg\\1molO\end{cases}\)
\(\Rightarrow\) trong 0,25 mol Ag2O có 0,5 mol Ag
\(\Rightarrow\) trong 0,5 mol Ag có \(\frac{56\%.0,5}{100\%}=0.28\left(mol\right)\) đồng vị 107Ag
\(\Rightarrow m_{^{107}Ag}\) = 107 . 0,28 = 29,96 (gam)
Bài 2:
a) Gọi x, y lần lượt là % về số nguyên tử của 2 đồng vị 35Cl và 37Cl, ta có:
\(\begin{cases}x+y=100\\\frac{35x+37y}{100}=35,5\end{cases}\)\(\Leftrightarrow\)\(\begin{cases}x=75\\y=25\end{cases}\)
Vậy đồng vị 35Cl chiếm 75%; đồng vị 37Cl chiếm 25%
b) Tính % về gì vậy bạn?
c) \(M_{AlCl_3}\) = 27 + (35,5 .3) = 133,5
\(\Rightarrow n_{AlCl_3}\) = \(\frac{13,35}{133,5}=0,1\left(mol\right)\)
Xét trong 1 mol AlCl3 có \(\begin{cases}1molAl\\3molCl\end{cases}\)
=> trong 0,1 mol AlCl3 có 0,3 mol Cl
=> trong 0,3 mol Cl có \(\frac{75\%.0,3}{100\%}=0,225\left(mol\right)\) đồng vị 35Cl
=> Số nguyên tử 35Cl có trong 13,35g AlCl3 là:
0,225 . 6,02 . 1023 = 1,3545.1023 (nguyên tử)
Đúng 1
Bình luận (0)
1)Cách 1: nhẩm nhanh cho các bài có Z nhỏ, Z lớn vẫn có thể áp dụng nếu bạn gần như đã thuộc bảng tuần hoàn-để có thể suy ra đáp án :d) lấy 10/3 xấp xỉ 3,333 => lấy số gần nhất là 3 tương đương với Z của Nguyên tử cần tìm => Li (giải thích: tổng 3 hạt là E,N,P trong đó E P bằng nhau(, N thì lớn hơn hoặc bằng P, nên muốn tìm Z (Z = E =P) thì chia 3 ra (3 hạt), lấy số đó hoặc phần nguyên nếu lẻ), Z nhỏ thì NP không khác nhau nhiều, còn Z lớn ví dụ (Fe Z=26, N=30, tổng số hạt là 82 chia 3 ra thì là 27,333...không còn đúng nữa.!
Cách 2: cách chính quy dùng cho Kt trên lớp, kiếm điểm:D:
3≤ (2Z+N)/Z < 3,5 (*)=> 2,8...<Z<3,33... => Z=3 (Li) cách này áp dụng cho mọi bài tập dạng này. để hiểu rõ hơn vì sao có công thức (*) bạn nghiên cứu thêm bài tập 1.19 trong sách bài tập hóa lớp 10 trang 6.
2)Mtb= 109*44%+X*(100-44)%=107,88 => X=107
Đúng 1
Bình luận (0)
Hai bình điện phân: (Fe
C
L
3
/Fe và Cu
S
O
4
/Cu) mắc nối tiếp. Sau một khoảng thời gian, bình thứ nhất giải phóng một lượng sắt là 1,4 g. Tính lượng đồng giải phóng ở bình thứ hai trong cùng khoảng thời gian đó. Biết nguyên tử lượng của đồng và sắt là 64 và 56, hóa trị của đồng và sắt là 2 và 3.
Đọc tiếp
Hai bình điện phân: (Fe C L 3 /Fe và Cu S O 4 /Cu) mắc nối tiếp. Sau một khoảng thời gian, bình thứ nhất giải phóng một lượng sắt là 1,4 g. Tính lượng đồng giải phóng ở bình thứ hai trong cùng khoảng thời gian đó. Biết nguyên tử lượng của đồng và sắt là 64 và 56, hóa trị của đồng và sắt là 2 và 3.
Nguyên tử đồng ( Cu) nặng gấp mấy lần nguyên tử lưu huỳnh (S)?
( Biết Cu = 64; S = 32)
A. 1,5 lần.
B. 2 lần.
C. 2,5 lần.
D. 3 lần.
\(d_{\dfrac{Cu}{S}}=\dfrac{PTK_{Cu}}{PTK_S}=\dfrac{64}{32}=2\left(lần\right)\)
Chọn B
Đúng 2
Bình luận (1)
Xem thêm câu trả lời
Một bình điện phân có anôt là
Ag
nhúng trong dung dịch
AgNO
3
, một bình điện phân khác có anôt là Cu nhúng trong dung dịch
CuSO
4
. Hai bình đó mắc nối tiếp nhau vào một mạch điện. Sau 2 giờ, khối lượng của cả hai catôt tăng lên 4,2 g. Tính cường độ dòng điện đi qua hai bình điện phân và khối lượng Ag và Cu bám vào catôt mỗi bình. Biết đồng có khối lượng mol nguyên tử là 64 g/mol, hoá trị...
Đọc tiếp
Một bình điện phân có anôt là Ag nhúng trong dung dịch AgNO 3 , một bình điện phân khác có anôt là Cu nhúng trong dung dịch CuSO 4 . Hai bình đó mắc nối tiếp nhau vào một mạch điện. Sau 2 giờ, khối lượng của cả hai catôt tăng lên 4,2 g. Tính cường độ dòng điện đi qua hai bình điện phân và khối lượng Ag và Cu bám vào catôt mỗi bình. Biết đồng có khối lượng mol nguyên tử là 64 g/mol, hoá trị 2 và bạc có khối lượng mol nguyên tử là 108 g/mol, hoá trị 1.
Ta có: m 1 = A 1 I t F n 1 ; m 2 = A 2 I t F n 2 ; m 1 + m 2 = ( A 1 n 1 + A 2 n 2 ) . I t F
⇒ I = ( m 1 + m 2 ) F A 1 n 1 + A 2 n 2 t = 0 , 4 A ; m 1 = A 1 I t F n 1 = 3 , 24 g ; m 2 = m - m 1 = 0 , 96 g
Đúng 0
Bình luận (0)
Hai bình điện phân: (
CuSO
4
/
Cu
và
AgNO
3
/
Ag
) mắc nối tiếp. Trong một mạch điện. Sau một thời gian điện phân, khối lượng catôt của hai bình tăng lên 2,8g. Biết đồng có khối lượng mol nguyên tử là 64 g/mol, hoá trị 2 và bạc có khối lượng mol nguyên tử là 108 g/mol, hoá trị 1.a) Tính điện lượng qua các bình điện phân và khối lượng Cu và Ag được giải phóng ở...
Đọc tiếp
Hai bình điện phân: ( CuSO 4 / Cu và AgNO 3 / Ag ) mắc nối tiếp. Trong một mạch điện. Sau một thời gian điện phân, khối lượng catôt của hai bình tăng lên 2,8g. Biết đồng có khối lượng mol nguyên tử là 64 g/mol, hoá trị 2 và bạc có khối lượng mol nguyên tử là 108 g/mol, hoá trị 1.
a) Tính điện lượng qua các bình điện phân và khối lượng Cu và Ag được giải phóng ở catôt.
b) Nếu cường độ dòng điện bằng 0,5 A. Tính thời gian điện phân.
a) m = m 1 + m 2 = 1 F . A 1 n 1 I t + 1 F . A 2 n 2 . I t = A 1 n 1 + A 2 n 2 . 1 F I t
⇒ q = I t = m F A 1 n 1 + A 2 n 2 = 2 , 8 . 96500 64 2 + 108 1 = 1930 ( C ) .
Khối lượng đồng được giải phóng ở catôt: m 1 = 1 F . A 1 n 1 q = 0 , 64 g
Khối lượng bạc được giải phóng ở catôt: m 2 = 1 F . A 2 n 2 q = 2 , 16 g
b) Thời gian điện phân: t = q I = 3860 s = 1 giờ 4 phút 20 giây.
Đúng 0
Bình luận (0)
g. Nguyên tử khối trung bình của Cu là 63,54. Đồng có 2 đồng vị. Biết đồng vị 1 là Cu chiếm 73%. Tìm đồng vị thứ 2. Hỏi khi có 54 nguyên tử đồng vị 2 thì sẽ có bao nhiêu nguyên tử Cu