Hòa tan 3,1 gam N a 2 O vào nước được 2 lít dung dịch. Nồng độ mol của dung dịch thu được là
A. 0,05 M
B. 0,1 M
C. 0,3M
D. 0,4M
Hòa tan 3,1 gam N a 2 O vào nước được 2 lít dung dịch. Nồng độ mol của dung dịch thu được là
A. 0,05 M
B. 0,1 M
C. 0,3M
D. 0,4M
Hòa tan 3,1 gam N a 2 O vào nước được 2 lít dung dịch A. Tính nồng độ mol/lit của dung dịch A
A. 0,025 mol
B. 0,075 mol
C. 0,5 mol
D. 0,275 mol
Hòa tan hoàn toàn 3,1 g Na2O vào 500ml nước thu được dung dịch A
a- Viết PTHH cho biết dd A làm quỳ tím đổi màu như thế nào ?
b- Tính nồng độ mol của dung dịch A (Xem như thể tích dung dịch không đổi)
c- Tính khối lượng dung dịch A
d- Tính nồng độ phần trăm của dung dịch A (Biết khối lượng riêng của nước là 1 g/ml)
a, \(n_{Na_2O}=\dfrac{3,1}{62}=0,05\left(mol\right)\)
PTHH: Na2O + H2O → 2NaOH
Mol: 0,05 0,1
⇒ ddA (NaOH) làm quỳ tím đổi màu xanh
b, \(C_{M_{ddNaOH}}=\dfrac{0,1}{0,5}=0,2M\)
c, \(m_{ddA}=3,1+1.500=503,1\left(g\right)\)
d, \(C\%_{ddNaOH}=\dfrac{0,2.40.100\%}{503,1}=1,59\%\)
Hòa tan 6,2 gam N a 2 O vào nước được 2 lít dung dịch. Nồng độ mol của dung dịch thu được là
A. 0,1M
B. 0,2 M
C. 0,3M
D. 0,4M
Hòa tan hoàn toàn 3,1 g Na2O vào 500ml nước thu được dung dịch A
a- Viết PTHH cho biết dd A làm quỳ tím đổi màu như thế nào ?
b- Tính nồng độ mol của dung dịch A (Xem như thể tích dung dịch không đổi)
c- Tính khối lượng dung dịch A
d- Tính nồng độ phần trăm của dung dịch A (Biết khối lượng riêng của nước là 1 g/ml)
Hòa tan 6,2 gam Na2O vào nước thu được 2 lít dung dịch A. Nồng độ mol/lit của dung dịch A là
Câu 1
a. Hòa tan 60 gam NaCl vào 150 gam nước. Tính nồng độ phần trăm của dung dịch thu được.
b.Tính nồng độ mol của dung dịch khi hòa tan 32 gam NaOH trong 400ml nước. (coi thể tích dung dịch không đổi).
Câu 2 Hãy tính khối lượng H2O2 có trong 30 g dung dịch nồng 3% .
Câu 3 Tính khối lượng của NaOH có trong 300 ml dung dịch có nồng độ 0,15 M.
Cho Na= 23; O= 16; H=1.
Câu 4
Hãy nêu , giải thích được hiện tượng xảy ra trong thí nghiệm và viết phương trình hoá học .Từ đó rút ra nhận xét về tính chất của acid khi thực hiện các thí nghiệm sau:
a.Thả miếng giấy quì tím vào lọ đựng dung dịch sulfuric acid (H2SO4)
b.Cho viên kẽm (zinc) vào trong ống nghiệm có chứa dung dịch hydrochloric acid.
Câu 5
Cho kẽm (Zinc) dư tác dụng với 500 ml dung dịch hydrochloric acid 2 M, thu được V (lít) khí hydrogen (250C và 1 bar).
Tính khối lượng kẽm đã phản ứng và thể tích khí hydrogen thu được.
Bài 17: Hòa tan hoàn toàn 2,32 gam Fe3O4 bằng 1 lít dung dịch HCl 1M, kết thúc phản ứng thu được dung dịch X . Tính nồng độ mol chất tan trong dung dịch X. ( Coi thể tích dung dịch không đổi)
\(n_{Fe_3O_4}=0,01\left(mol\right)\\ Fe_3O_4+8HCl\rightarrow2FeCl_3+FeCl_2+4H_2O\\ n_{HCl}=1.1=1\left(mol\right)\\ V\text{ì}:\dfrac{0,01}{1}< \dfrac{0,1}{8}\Rightarrow HCl\text{dư}\\ \Rightarrow\text{dd}X:FeCl_2,FeCl_3,HCl\left(d\text{ư}\right)\\ n_{FeCl_2}=n_{Fe_3O_4}=0,01\left(mol\right)\\ n_{FeCl_3}=0,01.2=0,02\left(mol\right)\\ n_{HCl\left(d\text{ư}\right)}=1-0,01.8=0,92\left(mol\right)\\ V_{\text{dd}X}=V_{\text{dd}HCl}=1\left(l\right)\\ C_{M\text{dd}HCl\left(d\text{ư}\right)}=\dfrac{0,92}{1}=0,92\left(M\right)\\ C_{M\text{dd}FeCl_2}=\dfrac{0,01}{1}=0,01\left(M\right)\\ C_{M\text{dd}FeCl_3}=\dfrac{0,02}{1}=0,02\left(M\right)\)
Hòa tan 6,2 g N a 2 O vào nước được 2 lít dung dịch. Nồng độ mol của dung dịch thu được là:
A. 0,1M
B. 0,2 M
C. 0,3M
D. 0,4M
Chọn A
n N a 2 O = m N a 2 O M N a 2 O = 6,2 62 = 0,1 m o l
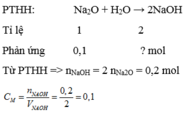
a. hòa tan 9,2 gam Na2O vào nước thì thu được 500ml dung dịch. tính nồng độ mol của dung dịch?
b. hòa tan 37,6 gam K2O vào 362,4 gam nước . tính nồng độ phần trăm của dung dịch?
Sửa đề: 9,2 gam Na
\(a,n_{Na_2O}=\dfrac{9,2}{23}=0,4\left(mol\right)\)
PTHH: \(Na_2O+H_2O\rightarrow2NaOH\)
0,4------------------>0,8
\(\rightarrow C_{M\left(NaOH\right)}=\dfrac{0,8}{0,5}=1,6M\)
\(b,n_{K_2O}=\dfrac{37,6}{94}=0,4\left(mol\right)\)
PTHH: \(K_2O+H_2O\rightarrow2KOH\)
0,4----------------->0,8
\(\rightarrow C\%_{KOH}=\dfrac{0,8.56}{362,4+37,6}.100\%=11,2\%\)