khi nào khối khí bị biến tính?
dẫn khí CO2 vào Ca(OH)2 0,1M quan sát kĩ ta thấy thoạt tiên xuất hiện một muối kết tủa trắng có khối lượng là 5g sau đó kết tủa từ từ biến mất
a) Viết sơ đồ thể hiện thí nghiệm
b) Tính thể tích khí CO2 đã dùng đến khi phản ứng tạo ra muối tan kết thúc ở đktc?
c) Tính khối lượng và CM của muối tan
d) Tính thể tích khí CO2 đã dùng ở đktc trong trường hợp chỉ tạo ra kết tủa? Tính khối lượng của kết tủa
\(a.\left\{{}\begin{matrix}CO_2\\Ca\left(OH\right)_2\end{matrix}\right.\rightarrow CaCO_3\rightarrow Ca\left(HCO_3\right)_2\)
\(b.\) \(n_{CaCO_3}=0,05\left(mol\right)\)
\(PTHH:CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3+H_2O\)
\(\left(mol\right)\) \(0,05\) \(0,05\) \(0,05\)
\(PTHH:CaCO_3+CO_2+H_2O\rightarrow Ca\left(HCO_3\right)_2\)
\(\left(mol\right)\) \(0,05\) \(0,05\) \(0,05\)
\(\rightarrow V_{CO_2}=22,4.\left(0,05+0,05\right)=2,24\left(l\right)\)
\(c.V_{Ca\left(OH\right)_2}=\dfrac{0,05}{0,1}=0,5\left(l\right)\\ m_{Ca\left(HCO_3\right)_2}=0,05.162=8,1\left(g\right)\\ C_{M_{Ca\left(HCO_3\right)_2}}=\dfrac{0,05}{0,5}=0,1\left(M\right)\)
\(d.V_{CO_2}=0,05.22,4=1,12\left(l\right)\\ m_{\downarrow}=5\left(g\right)\)
a) Dẫn từ từ CO2 đến dư vào dung dịch Ca(OH)2 xảy ra phản ứng:
CO2 + Ca(OH)2 → CaCO3 + H2O
CO2 + CaCO3 + H2O → Ca(HCO3)2
Hiện tượng quan sát được: Dung dịch xuất hiện kết tủa trắng tăng dần đến cực đại, sau đó kết tủa tan dần đến hết.
b)\(n_{CaCO_3}=\dfrac{5}{100}=0,05\left(mol\right)\)
CO2 + Ca(OH)2 → CaCO3 + H2O
0,05<---0,05------------0,05
CO2 + CaCO3 + H2O → Ca(HCO3)2
0,05<----0,05-------------------->0,05
Theo PT ta có : \(n_{CO_2}=2n_{CaCO_3}=0,1\left(mol\right)\)
=> \(V_{CO_2}=0,1.22,4=2,24\left(l\right)\)
c)Theo PT ta có : \(n_{Ca\left(HCO_3\right)_2}=n_{CaCO_3}=0,05\left(mol\right)\)
=> \(m_{Ca\left(HCO_3\right)_2}=0,05.162=8,1\left(g\right)\)
Theo PT ta có : \(n_{Ca\left(OH\right)_2}=n_{CaCO_3}=0,05\left(mol\right)\)
\(V_{Ca\left(OH\right)_2}=\dfrac{0,05}{0,1}=0,5\left(l\right)\)
Giả sử thể tích dung dịch thay đổi không đáng kể:
=> \(CM_{Ca\left(HCO_3\right)_2}=\dfrac{0,05}{0,5}=0,1M\)
d) Trường hợp chỉ tạo ra kết tủa :
CO2 + Ca(OH)2 → CaCO3 + H2O
Theo PT : \(n_{CO_2}=n_{CaCO_3}=n_{Ca\left(OH\right)_2}=0,05\left(mol\right)\)
=> \(V_{CO_2}=0,05.22,4=1,12\left(l\right)\)
\(m_{CaCO_3}=0,05.100=5\left(g\right)\)
cho 8,4g sắt chảy trong bình chứa 1,12 L khí oxi
a. tính khối lượng oxit săt́ từ thu đc
b. chất nào còn dư sau phản ứng?, khối lượng chất dư là bn?
\(n_{Fe}=\dfrac{8,4}{56}=0,15\left(mol\right)\)
\(n_{O2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Pt : \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4|\)
3 2 1
0,15 0,05 0,025
a) Lập tỉ số so sánh : \(\dfrac{0,15}{3}>\dfrac{0,05}{2}\)
⇒ Fe dư , O2 phản ứng hết
⇒ Tính toán dựa vào số mol của O2
\(n_{Fe3O4}=\dfrac{0,05.1}{2}=0,025\left(mol\right)\)
⇒ \(m_{Fe3O4}=0,025.232=5,8\left(g\right)\)
b) \(n_{Fe\left(dư\right)}=0,15-\left(\dfrac{0,05.3}{2}\right)0,075\left(mol\right)\)
⇒ \(m_{Fe\left(dư\right)}=0,075.56=4,2\left(g\right)\)
Chúc bạn học tốt
\(n_{Fe}=\dfrac{8,4}{56}=0,15\left(mol\right);n_{O_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\\ a,PTHH:3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\\ Vì:\dfrac{0,05}{2}< \dfrac{0,15}{3}\Rightarrow Fedư\\ n_{Fe_3O_4}=\dfrac{1}{2}.n_{O_2}=\dfrac{0,05}{2}=0,025\left(mol\right)\\ m_{Fe_3O_4}=232.0,025=5,8\left(g\right)\\ b,n_{Fe\left(dư\right)}=0,15-\dfrac{3}{2}.0,05=0,075\left(mol\right)\\ \Rightarrow m_{Fe}\left(dư\right)=0,075.56=4,2\left(g\right)\)
Câu 38: Tính chất nào sau đây biến đổi tuần hoàn (đối với 20 nguyên tố đầu bảng)
A. Khối lượng nguyên tử B. Số proton trong hạt nhân nguyên tử
C. Số nơtron trong hạt nhân nguyên tử D. Số electron lớp ngoài cùng
Hỗn hợp A gồm SO2 và O2 có tỷ khối đối với H2 = 24 sau khi nung nóng vs V2O5 thu được hỗn hợp khí B có tỷ khối hơi đối với H2 là 30
a) Tính % thể tích mỗi khí trước và sau phản ứng
b)Tính% khối lượng về mỗi khí tham gia phản ứng
c) Tính H% phản ứng
/ Đốt cháy hoàn toàn 19,5g Zn trong khí oxi thu được ZnO.
a/ Viết PTHH. Phản ứng trên thuộc loại phản ứng nào?
b/ Tính khối lượng ZnO tạo thành
c/ Tính thể tích O2 PƯ
\(n_{Zn}=\dfrac{m_{Zn}}{M_{Zn}}=\dfrac{19,5}{65}=0,3mol\)
\(Zn+\dfrac{1}{2}O_2\rightarrow\left(t^o\right)ZnO\)
1 1/2 1 (mol)
0,3 0,15 0,3 ( mol )
PƯ trên thuộc loại phản ứng hóa hợp
\(m_{ZnO}=n_{ZnO}.M_{ZnO}=0,3.81=24,3g\)
\(V_{O_2}=n_{O_2}.22,4=0,15.22,4=3,36l\)
a. \(n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\)
PTHH : 2Zn + O2 -> 2ZnO ( Phản ứng hóa hợp )
0,3 0,15 0,3
b. \(m_{ZnO}=0,3.81=24,3\left(g\right)\)
c. \(V_{O_2}=0,15.22,4=3,36\left(l\right)\)
Một khí khi đặt ở điều kiện nhiệt độ không đổi thì có sự biến thiên của thể tích theo áp suất như hình V.2. Khi áp suất có giá trị 500 N / m 2 thì thể tích khối khí bằng
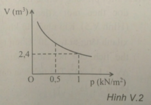
A. 3 , 6 m 3
B. 4 , 8 m 3
C. 1 , 2 m 3
D. 20 m 3
Chọn B.
Áp dụng phương trình trạng thái ta được:
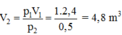
Một khí khi đặt ở điều kiện nhiệt độ không đổi thì có sự biến thiên của thể tích theo áp suất như hình V.2. Khi áp suất có giá trị 500 N/ m 2 thì thể tích khối khí bằng
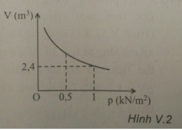
A. 3,6 m 3 .
B. 4,8 m 3
C. 1,2 m 3 .
D. 20 m 3
Chọn B.
Áp dụng phương trình trạng thái ta được:
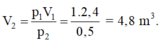
ai bt làm giúp mk vs!!!![]()
CÂU 1: tính khối lượng mol của khí A biết khí A có tỉ khối với khí x là 0,5. biết 1 lít khí x ở (đktc) nặng 1,428 gam. vậy khối lượng của khí A là bao nhiêu gam và khí A có số mol là bao nhiêu ???
CÂU 2:có các khí : H2, N2, CO2, O2, CO4 khí nào thu được bằng cách:
a,đặt đứng bình thu
b, đặt ngược bình thu
CÂU 3: biết khí A có tỉ khối so với khí khí Oxi là 2, khí A được tạo bởi lưu huỳnh và Oxi trong đó phần trăm khối lượng của 2 nguyên tố này là bằng nhau. Vậy khí A là khí nào , phải lấy bao nhiêu gam khí A để có cùng số phân tử với 0,25 mol khí CH4
2. a/ Các khí thu được bằng cách đặt đứng bình là: N2; CO2; CO4
b/ Các khi được thu bằng cách đặt ngược bình là H2
Câu 1: Đốt cháy hoàn toàn 6,5 gam Kẽm trong bình oxi dư
a. Tính thể tích oxi đã dùng(đktc)
b. Tính khối lượng sản phẩm tạo thành ?
c. nếu trong bình trên có chứa 0,8 gam khí oxi thì chất nào còn dư sau phản ứng? Tìm khối lượng sản phẩm tạo thành
2Zn+O2-to>2ZnO
0,1---0,05----0,1
n Zn=0,1 mol
nO2=0,025 mol
=>VO2=0,05.22,4=1,12l
=>mZnO=0,1.81=8,1g
c)Zn dư
=>m ZnO=0,05.81=4,05g
2Zn+O2-to>2ZnO
0,1---0,05----0,1
n Zn=6,5/65=0,1 mol
n O2=0,8/32=0,025 mol
=>VO2=0,05.22,4=1,12l
=>mZnO=0,1.81=8,1g
c)Zn dư
=>m ZnO=0,05.81=4,05g