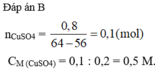Có 200 gam CuSO4 trong 2 lít dung dịch.Hãy tính nồng độ mol của dung dịch.

Những câu hỏi liên quan
a/ Tính nồng độ phần trăm của 15 gam CuSO4 có trong 200 gam dung dịch.
b/ Tính nồng độ phần trăm của 2 mol HCl có trong 500 gam dung dịch
a)
\(C\%_{CuSO_4} = \dfrac{15}{200}.100\% = 7,5\%\\ \)
b)
m HCl = 36,5.2 = 73(gam)
\(C\%_{HCl} = \dfrac{73}{500}.100\% = 14,6\%\)
Đúng 1
Bình luận (0)
Bài 1:Thế nào là oxit?Cho 2 ví dụ minh hoạBài 2:Viết công thức tính nồng độ mol của dung dịch.Hãy tính nồng độ mol của 2,5 mol CuSO4 trong 4 lít dung dịchBài 3:Lập phương trình hoá học biễu diễn phản ứng sau và xác định loại phản ứng?a.Đồng(II) oxit+khí hidro- đồng+nướcb.Lưu huỳnh trioxit+nước - axit sunfuricBài 4:a.Hãy gọi tên các hợp chất sau:HNO3;Ca(OH)2b.Viết công thức hoá học của muối có tên sau:-Kali sunfat-Natri hidrocacbonat
Đọc tiếp
Bài 1:Thế nào là oxit?Cho 2 ví dụ minh hoạ
Bài 2:Viết công thức tính nồng độ mol của dung dịch.Hãy tính nồng độ mol của 2,5 mol CuSO4 trong 4 lít dung dịch
Bài 3:Lập phương trình hoá học biễu diễn phản ứng sau và xác định loại phản ứng?
a.Đồng(II) oxit+khí hidro-> đồng+nước
b.Lưu huỳnh trioxit+nước -> axit sunfuric
Bài 4:
a.Hãy gọi tên các hợp chất sau:HNO3;Ca(OH)2
b.Viết công thức hoá học của muối có tên sau:
-Kali sunfat
-Natri hidrocacbonat
Bài 1: Bạn tự học nhé
Bài 2:
\(C_M=\dfrac{n}{V}=\dfrac{2,5}{4}=0,625M\)
Bài 3:
\(a,CuO+H_2\xrightarrow[]{t^o}Cu+H_2O\\ b,SO_3+H_2O\rightarrow H_2SO_4\)
Bài 4:
a, HNO3 - axit nitric
Ca(OH)2 - canxi hiđroxit
b, K2SO4
NaHCO3
Đúng 7
Bình luận (0)
mình làm nốt bài 1 :)))
oxit là 1 hợp chất trong đó có 1 hay nhiều nguyên tử Oxi liên kết với 1 đơn chất
VD : CO2 , FeO
Đúng 1
Bình luận (0)
Hãy tính nồng độ mol của những dung dịch sau :
A. 0,5 mol MgCl2 trong 1,5 lít dung dịch
B. 400 gam CuSO4 trong 4 lít dung dịch
a) CM MgCl2 = 0,5/1,5 = 0,33M
b) n CuSO4 = 400/160 = 2,5(mol)
CM CuSO4 = 2,5/4 = 0,625M
Đúng 1
Bình luận (0)
a) `CM_(MgCl_2) = (0,5)/(1,5)`\(\approx\)`0,33 M`
b) `n_(CuSO_4)=2,5(mol)`
→ `CM_(CuSO_4)=(2,5)/4=0,625 M`
Đúng 0
Bình luận (0)
hãy tính nồng độ mol của dung dịch sau: 400 gam CuSO 4 trong 4 lít dung dịch
a) Trong 200 ml dung dịch CuSO4 có hòa tan 16gam CuSO4. Hãy tính nồng độ mol của dung dịch trên.b)Tính số gam chất tan cần dùng để pha chế 2lít dung dịch NaCl 0,9M.
Đọc tiếp
a) Trong 200 ml dung dịch CuSO4 có hòa tan 16gam CuSO4. Hãy tính nồng độ mol của dung dịch trên.
b)Tính số gam chất tan cần dùng để pha chế 2lít dung dịch NaCl 0,9M.
a)
$n_{CuSO_4} = \dfrac{16}{160} = 0,1(mol)$
$C_{M_{CuSO_4}} = \dfrac{0,1}{0,2} = 0,5M$
b)
$n_{NaCl} = 0,9.2 = 1,8(mol)$
$m_{NaCl} = 1,8.58,5 = 105,3(gam)$
Đúng 2
Bình luận (0)
Ngâm một đinh sắt sạch trong 200 ml dung dịch
C
u
S
O
4
sau khi phản ứng kết thúc, lấy đinh sắt ra khỏi dung dịch rửa nhẹ làm khô nhận thấy khối lượng đinh sắt tăng thêm 0,8 gam. Nồng độ mol/lít của dung dịch
C
u
S
O
4
đã dùng là: A. 0,3M. B. 0,5M. C. 0,4M. D. 0,25M.
Đọc tiếp
Ngâm một đinh sắt sạch trong 200 ml dung dịch C u S O 4 sau khi phản ứng kết thúc, lấy đinh sắt ra khỏi dung dịch rửa nhẹ làm khô nhận thấy khối lượng đinh sắt tăng thêm 0,8 gam. Nồng độ mol/lít của dung dịch C u S O 4 đã dùng là:
A. 0,3M.
B. 0,5M.
C. 0,4M.
D. 0,25M.
a) Nồng độ phần trăm của dung dịch có chứa 15gam NaCl trong 60gam dung dịch.
b) Nồng độ mol của dung dịch có chứa 0,1 mol CuSO4 .trong 0,2 lít dung dịch.
\(a,C\%=\dfrac{15}{60}.100=25\%\)
\(b,CM=\dfrac{0,1}{0,2}=0,5M\)
Đúng 1
Bình luận (0)
Nhúng một thanh nhôm nặng 25 gam vào 200 ml dung dịch CuSO4 0,5M. Sau một thời gian, cân lại thanh nhôm thấy cân nặng 25,69 gam. Tính nồng độ mol của các chất có trong dung dịch sau phản ứng.
Al: 25 gam + 0,1 mol CuSO4 → thanh nhôm nặng 25,69 gam.
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
Sau phản ứng mtăng = 25,69 - 25 = 0,69 gam
=> \(n_{Al} = 2. \dfrac{0,69}{3 .64 - 2 . 27} = 0,01 mol\)
=> nAl2(SO4)3 = 0,005 mol; nCuSO4dư = 0,1 - 0,015 = 0,085 mol
=> CM Al2(SO4)3= 0,025 M; CM CuSO4 = 0,425 M
Đúng 2
Bình luận (0)
a) Có 40 g KCl trong 800g dung dịch.Tính nồng độ phần trăm của dung dịch KCI? b) Hòa tan 1,5 mol CuS*O_{4} vào nước thu được 0,75 lít dung dịch. Tính nồng độ mol của dung dịch CuSO4?
a, \(C\%_{KCl}=\dfrac{40}{800}.100\%=5\%\)
b, \(C_M=\dfrac{n}{V}=\dfrac{1,5}{0,75}=2M\)
Đúng 2
Bình luận (0)