Hòa tan 2,8g Fe bằng dung dịch HCl 2M vừa đủ, Tính thể tích dd HCl cần dùng

Những câu hỏi liên quan
Hòa tan 5,4g nhôm bằng một lượng vừa đủ dd HCl 15%
a/ Tính khối lượng muối tạo thành và thể tích khí hidro sinh ra ở đktc.
b/ Tính khối lượng dd HCl đã dùng
\(2Al + 6HCl \rightarrow 2AlCl_3 + 3H_2\)
\(n_{Al}= \dfrac{5,4}{27}= 0,2 mol\)
Theo PTHH:
\(n_{AlCl_3}= n_{Al}= 0,2 mol\)
\(\Rightarrow m_{AlCl_3}= 0,2 . 133,5=26,7 g\)
Theo PTHH:
\(n_{H_2}= \dfrac{3}{2} n_{Al}= 0,3 mol\)
\(\Rightarrow V= 0,3 . 22,4= 6,72 l\)
b)
Theo PTHH:
\(n_{HCl}= 3n_{Al}= 0,6 mol\)
\(\Rightarrow m_{HCl}= 0,6 . 36,5=21,9 g\)
\(\Rightarrow m_{dd HCl}= \dfrac{21,9 . 100}{15}= 146 g\) ( nếu ở tử là : 21,9 . 100% thì ở mẫu bạn chia cho 15% nhé)
Đúng 1
Bình luận (0)
1 )hòa tan hoàn toàn 5,4 g nhôm bằng lượng vừa đủ dung dịch Hcl 16%
a) tính klg dung dịch Hcl đã dùng
b) tính C% dung dịch muối sau phản ứng
a) \(n_{Al}=\dfrac{m}{M}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
\(PTHH:2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
Số mol : 2mol.........6mol
Sau p/ư : 0,2mol........ x
\(n_{HCl}=x=\dfrac{0,2.6}{2}=0,6\left(mol\right)\)
Ta có : \(n_{HCl}=\dfrac{16\%.m_{HCl}}{100\%.36,5}\)
\(\Rightarrow0,6=\dfrac{16.m_{HCl}}{100.36,5}\)
\(\Rightarrow m_{HCl}=\dfrac{2190}{16}=136,875\left(g\right)\)
b) \(n_{AlCl_3}=\dfrac{3}{2}n_{Al}=0,3\left(mol\right)\)
\(m_{AlCl_3}=0,3.133,5=40,05\left(g\right)\)
\(\Rightarrow C_{\%ddAlCl_3}=\dfrac{40,05}{5,4+136,875}.100\approx27,95\%\)
Đúng 0
Bình luận (3)
nAl=5,4/27=0,2(mol)
PT:
2Al + 6HCl -> 2AlCl3 + 3H2↑
0.2........0.6........0.2..........0.3 (mol)
a) mHCl=0,6.36,5=21,9 (g)
b)mAlCl3=0.2*133.5=26.7(g)
=> C% (AlCl3)=(26.7/(21.9*100/16+5.4))*100%=18.766%
Đúng 0
Bình luận (1)
nAl = 0,2 mol
2Al + 6HCl \(\rightarrow\) 2AlCl3 + 3H2
0,2.....0,6...........0,6..........0,3
\(\Rightarrow\) mHCl đã dùng = \(\dfrac{0,6.36,5.100}{16}\) = 136,875 (g)
\(\Rightarrow\) mdd sau phản ứng = 5,4 + 136,875 - ( 0,3.2 ) = 141,675 (g)
\(\Rightarrow\) C%dd muối sau phản ứng = \(\dfrac{0,2.133,5.100}{141,675}\) \(\approx\) 18,8%
Đúng 0
Bình luận (0)
cho 21 gam MgCO3 tác dụng với một lượng vừa đủ dung dịch HCl 2M
a) viết PTHH
b) tính thể tích dung dịch HCl đã dùng
\(n_{MgCO_3}=\dfrac{21}{84}=0,25\left(mol\right)\\ a.MgCO_3+2HCl\rightarrow MgCl_2+CO_2+H_2O\\ n_{HCl}=0,25.2=0,5\left(mol\right)\\ b.V_{ddHCl}=\dfrac{0,5}{2}=0,25\left(l\right)=250\left(ml\right)\)
Đúng 2
Bình luận (0)
. Hòa tan 6,4 gam hỗn hợp gồm Mg, MgO vào dung dịch HCl 0,5M vừa đủ thu được dung dịch A và 2,24 lít khí (đktc).
a. Tính thành phần phần trăm về khối lượng của Mg, MgO trong hỗn hợp ban đầu.
b. Tính thể tích của dung dịch HCl đã dùng.
c. Tính nồng độ mol của dung dịch A.
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1(mol)\\ Mg+2HCl\to MgCl_2+H_2\\ MgO+2HCl\to MgCl_2+H_2O\\ \Rightarrow n_{Mg}=0,1(mol)\\ \Rightarrow \%_{Mg}=\dfrac{0,1.24}{6,4}.100\%=37,5\%\\ \Rightarrow \%_{MgO}=100\%-37,5\%=62,5\%\)
\(b,n_{MgO}=\dfrac{6,4-0,1.24}{40}=0,1(mol)\\ \Rightarrow n_{HCl}=2.0,1+2.0,1=0,4(mol)\\ \Rightarrow V_{dd_{HCl}}=\dfrac{0,4}{0,5}=0,8(l)\\ c,n_{MgCl_2}=0,1+0,1=0,2(mol)\\ \Rightarrow C_{M_{MgCl_2}}=\dfrac{0,2}{0,8}=0,25M\)
Đúng 2
Bình luận (0)
Đốt cháy hòa toàn 15,4g hỗn hợp X gồm các kim loại Fe, Mg, Al thu được 25,1 g hỗn hợp các oxit Y. Hòa tan B bằng HCl 2M thì cần dùng thể tích là:
A. 0,6 lít
B. 0,525 lít
C. 0,6125 lít
D. 0,74 lít
Đáp án C
m = moxit - mkim loại = 25,1 - 15,3 = 9,8g
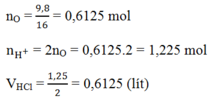
Đúng 0
Bình luận (0)
hòa tan hoàn toàn 13,2(g) hỗn hợp hai bột ZnO và Al2O3 vào 250 (ml) dung dịch HCl 2M (vừa đủ)
a) tính thành phần % theo khối lượng mỗi chất trong hỗn hợp
b) tính nồng độ mol của các muối trong dung dịch sau phản ứng (thể tích dung dịch thay đổi không đáng kể)
Cho 6,4g hỗn hợp A gồm Fe và Mg phản ứng với 100g dung dịch H2SO4 loãng vừa đủ được 3,584 lít (đkc) và dung dịch B a, tính % theo khối lượng mỗi chất có trong A b, tính C% của từng muối trong dung dịch B c, đốt cháy 6,4g hỗn hợp A ở trên với hỗn hợp khí X gồm Cl2 và O2, sau phản ứng chỉ thu được hỗn hợp Y gồm các oxit và muối clorua (không có khí dư). Hòa tan Y bằng 1 lượng vừa đủ 120ml dung dịch HCl 2M thu được dung dịch Z. Cho AgNO3 dư v...
Đọc tiếp
Cho 6,4g hỗn hợp A gồm Fe và Mg phản ứng với 100g dung dịch H2SO4 loãng vừa đủ được 3,584 lít (đkc) và dung dịch B a, tính % theo khối lượng mỗi chất có trong A b, tính C% của từng muối trong dung dịch B c, đốt cháy 6,4g hỗn hợp A ở trên với hỗn hợp khí X gồm Cl2 và O2, sau phản ứng chỉ thu được hỗn hợp Y gồm các oxit và muối clorua (không có khí dư). Hòa tan Y bằng 1 lượng vừa đủ 120ml dung dịch HCl 2M thu được dung dịch Z. Cho AgNO3 dư vào dung dịch Z thu được 56,69g kết tủa. Tính % theo thể tính của Cl2 trong hỗn hợp X
1) Hòa tan 2,4g MG vào dung dịch HCL dư. Viết phương trình hóa học và tính khối lượng muối tạo thành.
2) Hòa tan m gam Fe vừa đủ vào 150ml dd HCL chưa biết nồng độ. Phản ứng kết thúc thu được 3,36 lít khí H2(đktc)
a) Viết pthh xảy ra
b) tính khối lượng sắt đã phản ứng
c) tính nồng độ mol của dd HCL đã dùng
3) Cho 200ml dd AgNO3 2M tác dụng vừa đủ với 300ml dd Cacl2.
a) hãy cho biết hiện tượng quan sát được và viết pthh
b) Tính khối...
Đọc tiếp
1) Hòa tan 2,4g MG vào dung dịch HCL dư. Viết phương trình hóa học và tính khối lượng muối tạo thành.
2) Hòa tan m gam Fe vừa đủ vào 150ml dd HCL chưa biết nồng độ. Phản ứng kết thúc thu được 3,36 lít khí H2(đktc)
a) Viết pthh xảy ra
b) tính khối lượng sắt đã phản ứng
c) tính nồng độ mol của dd HCL đã dùng
3) Cho 200ml dd AgNO3 2M tác dụng vừa đủ với 300ml dd Cacl2.
a) hãy cho biết hiện tượng quan sát được và viết pthh
b) Tính khối lượng chất rắn sinh ra
c) Tính nồng độ mol của dung dịch sau phản ứng. Cho biết thể tích dung dịch thay đổi không đáng kể
4) Cho 3,2g CuO tác dụng vừa đủ với dung dịch H2SO4 4,9 %
a) viết pthh
b) Tính nồng độ % của dd CuSO4
Mn giải giúp mình nhea...Cảm ơn nhiều ạ :>>
Bn tách câu hỏi ra nhỏ giúp mk !
Hòa tan 10 gam hỗn hợp gồm Mg và MgO vào 100 ml dd HCl vừa đủ thu được 5,6 lít khí ở đktc và dung dịch X.
a. Tính phần trăm khối lượng mỗi chất trong hỗn hợp ban đầu.
b. Tính CM của dd axit đã dùng.
a. \(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
0,25 ..... 0,5 ................... 0,25 (mol)
\(m_{Mg}=0,25.24=6\left(g\right)\)
\(\rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{6}{10}.100\%=60\%\\\%m_{MgO}=100\%-60\%=40\%\end{matrix}\right.\)
\(MgO+2HCl\rightarrow MgCl_2+H_2O\)
0,1 ....... 0,2 (mol)
\(n_{HCl}=0,25+0,1=0,35\left(mol\right)\)
\(C_M\left(HCl\right)=\dfrac{0,35}{0,1}=3,5\left(M\right)\)
Đúng 2
Bình luận (0)























