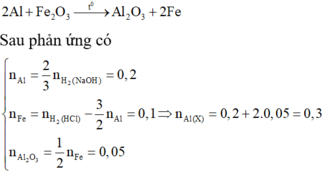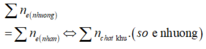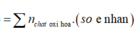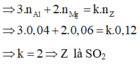Cho : Al + S --> Al2S3
Biết số mol của Al là 0,3. Tính số mol của S

Những câu hỏi liên quan
a)Tính số mol của S có trong 16g lưu huỳnh
b)Tính số mol Al có trong 5,4g nhôm
c)Tính số mol Fe2O4 CÓ TRONG 6,96g ooxxit sắt từ
d)Tính soos mol CO2 có trong 4,4g cacbonnic
n=\(\dfrac{m}{M}\)
nS = \(\dfrac{16}{32}\)= 0,5 mol
nAl = \(\dfrac{5,4}{27}\)= 0,2 mol
nFe3O4 = \(\dfrac{6,96}{232}\)= 0,03 mol
nCO2 = \(\dfrac{4,4}{44}\)= 0,1 mol
Đúng 1
Bình luận (0)
cho 0,1 mol Al; 0,2 mol Fe; 0,3 mol Zn tac dụng với 0,5 mol AgNO3; 0,6 mol Cu(NO3)2. Tính số mol chất dư còn lại
Hỗn hợp có 0,2 mol Ag và 0,3 mol Al được cho vào H2SO4 loãng (dư),thấy có V(lít) khí thoát ra (đkc). Tìm giá trị của V?
Cho Al=27,Ag=108,S=32,O=16
Cảm ơn trước ạ
Theo dãy hoạt động hóa học của kim loại thì Ag không phản ứng với \(H_2SO_4\) loãng
→ Chỉ có Al pứ
\(PTHH:2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
(mol)____0,3__________________________0,45_
\(V_{H_2}=V=0,45.22,4=10,08\left(l\right)\)
Đúng 0
Bình luận (0)
Thực hiện phản ứng nhiệt nhôm 0,35 mol Al với 0,3 mol Fe 2 O 3 thu được 0,2 mol Fe. Hiệu suất của phản ứng là
A. 66,67%
B. 57,14%
C. 83,33%
D. 68,25%
tính số mol của 8,2g Al ? (biết Al = 27)
\(n_{Al}=\dfrac{m}{M}=8,2:27=0,303\left(mol\right)\)
Đúng 1
Bình luận (1)
Đốt X gồm Fe2O3 và Al (không có không khí) cho đến khi phản ứng xảy ra hoàn toàn. Những chất rắn sau phản ứng: - Nếu cho tác dụng với dung dịch NaOH dư sẽ thu được 0,3 mol H2. - Nếu cho tác dụng vói dung dịch HC1 dư sẽ thu được 0,4 mol H2. Số mol Al trong X là: A. 0,3 mol B. 0,6 mol C. 0,4 mol D. 0,25 mol
Đọc tiếp
Đốt X gồm Fe2O3 và Al (không có không khí) cho đến khi phản ứng xảy ra hoàn toàn. Những chất rắn sau phản ứng:
- Nếu cho tác dụng với dung dịch NaOH dư sẽ thu được 0,3 mol H2.
- Nếu cho tác dụng vói dung dịch HC1 dư sẽ thu được 0,4 mol H2.
Số mol Al trong X là:
A. 0,3 mol
B. 0,6 mol
C. 0,4 mol
D. 0,25 mol
C1:nêu ý nghĩa của các CTHH :Fe2O3,FeSO4,Fe2(SO4)3
C2:Tính số mol và thể tích của hỗn hợp khí gồm:0,88 (g) CO2,0,14 (g) N2 và 0,28 (g) CO.
C3:Hợp chất B có %Al=15,79%,%S=28,07%,còn lại là O.Biết khối lượng mol B là 342.Viết CTHH dưới dạng A1x(SO4)y
Cho hỗn hợp gồm Fe và Al tác dụng vừa đủ với 12,8g S thu được 23,8g muối. Tính % về số mol của Fe và Al trong hỗn hợp đó
\(Fe+S\rightarrow FeS\)
\(2Al+3S\rightarrow Al_2S_3\)
\(n_S=\frac{12,8}{32}=0,4\left(mol\right)\)
Gọi a là số mol Fe b là số mol Al
\(\left\{{}\begin{matrix}56a+27b=11\\a+1,5b=0,4\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a=0,1\\b=0,2\end{matrix}\right.\)
\(\Rightarrow\%n_{Fe}=\frac{0,1}{0,3}.100\%=33,33\%\)
Cho hỗn hợp X gồm 0,04 mol Al và 0,06 mol Mg tan hoàn toàn trong
H
2
SO
4
đặc nóng thu được 0,12 mol sản phẩm Z duy nhất do sự khử của
S
+
6
. Z là A.
H
2
S...
Đọc tiếp
Cho hỗn hợp X gồm 0,04 mol Al và 0,06 mol Mg tan hoàn toàn trong H 2 SO 4 đặc nóng thu được 0,12 mol sản phẩm Z duy nhất do sự khử của S + 6 . Z là
A. H 2 S .
B. S.
C. SO 2 .
D. SO 3 .