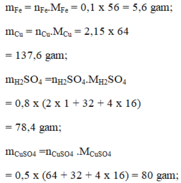Những câu hỏi liên quan
hãy tính.
a. Khối lượng của 0,3 mol acetic acid C2H4O2.
b. Thể tích của 0,15 mol khí sulfur dioxide SO2 (ở đkc 250C, 1atm).
c. Số mol của 19,6g H2SO4.
a) \(m_{C_2H_4O_2}=0,3.60=18\left(g\right)\)
b) \(V_{SO_2}=\dfrac{nRT}{P}=\dfrac{0,15.0,082.\left(273+25\right)}{1}=3,6654\left(l\right)\)
c) \(n_{H_2SO_4}=\dfrac{19,6}{98}=0,2\left(mol\right)\)
Đúng 1
Bình luận (0)
Tính số mol của 19,6g của axit sunfuric H2SO4? biết H=1, S= 32, O=16
\(n_{H_2SO_4}=\dfrac{19,6}{98}=0,2(mol)\)
Đúng 4
Bình luận (0)
\(n_{H_2SO_4}=\dfrac{19.6}{98}=0.2\left(mol\right)\)
Đúng 1
Bình luận (0)
Trong 400ml dung dịch có chứa 19,6g H2SO4. Nồng độ MOL của dung dịch đó là
Ta có: \(n_{H_2SO_4}=\dfrac{19,6}{98}=0,2\left(mol\right)\) \(\Rightarrow C_{M_{H_2SO_4}}=\dfrac{0,2}{0,4}=0,5\left(M\right)\)
Đúng 1
Bình luận (0)
Trong 200ml dung dịch có chứa 19,6g H2SO4. Nồng độ MOL của dung dịch đó là
\(n_{H_2SO_4}=\dfrac{19,6}{98}=0,2\left(mol\right)\)
\(C_{M_{H_2SO_4}}=\dfrac{0,2}{0,2}=1\left(M\right)\)
Đúng 1
Bình luận (0)
1 Tính số mol của H2SO4 trong 100 ml dd H2SO4 49% .
Sau đó tính nồng độ mol của H2SO4
2 Tính nồng độ mol của các dd sau
a 3,65g HCl trong 200 ml dd
b 0.2 mol H2SO4 trong 100 dd
1 thiếu m dd H2SO4 hoặc D nhé
2
\(a\) \(n_{HCl}=\dfrac{3,65}{36,5}=0,1mol\)
\(C_{M_{HCl}}=\dfrac{0,1}{0,2}=0,5M\)
\(b\) \(C_{M_{H_2SO_4}}=\dfrac{0,2}{0,2}=1M\)
Đúng 1
Bình luận (1)
Hãy tính khối lượng của 2 mol H2S 0,25 mol H2SO4 0,5 mol CuO
\(m_{H_2S}=2.34=68\left(g\right)\)
\(m_{H_2SO_4}=0,25.98=24,5\left(g\right)\)
\(m_{CuO}=0,5.80=40\left(g\right)\)
Đúng 2
Bình luận (0)
áp dụng công thức : m = n.M
Ta có : \(m_{H2S}\) = 2.34 = 68 (g)
\(m_{H2SO4}\) = 0,25 .98= 24,5 (g)
\(m_{CuO}\) = 0,5 . 80 = 40 (g)
Đúng 1
Bình luận (0)
Cho 24 gam fe2 o3 vào 200 ml dung dịch h2so4 2,5M a, hãy tính số mol các chất đã cho trước phản ứng B, tính số mol chất còn dư ( nếu có) sau phản ứng C, tính nồng độ mol của dung dịch sau phản ứng biết thể tích dung dịch thay đổi không đáng kể
a) $n_{Fe_2O_3} = \dfrac{24}{160} = 0,15(mol)$
$n_{H_2SO_4} =0,2.2,5 = 0,5(mol)$
b)
$Fe_2O_3 + 3H_2SO_4 \to Fe_2(SO_4)_3 + 3H_2O$
Vì :
$n_{Fe_2O_3} : 1 < n_{H_2SO_4} : 3$ nên $H_2SO_4$ dư
$n_{H_2SO_4\ pư} = 3n_{Fe_2O_3} = 0,45(mol)$
$n_{H_2SO_4\ dư} = 0,5 - 0,45 = 0,05(mol)$
c)
$n_{Fe_2(SO_4)_3} = n_{Fe_2O_3} = 0,15(mol)$
$C_{M_{Fe_2(SO_4)_3}} = \dfrac{0,15}{0,2} = 0,75M$
$C_{M_{H_2SO_4}} = \dfrac{0,05}{0,2} = 0,25M$
Đúng 2
Bình luận (0)
a)trong 200ml dung dịch có hòa tan 16g CaSO4. hãy tính nồng độ mol của dung dịch CuSO4
b)dung dịch H2SO4 có nồng độ 14 %.hãy tính khối lượng H2SO4 có trong 150 g dung dịch
a) \(n_{CuSO_4}=\dfrac{16}{160}=0,1\left(mol\right)\)
\(C_{M_{ddCuSO_4}}=\dfrac{0,1}{0,2}=0,5M\)
b) \(m_{H_2SO_4}=\dfrac{150.14}{100}=21\left(g\right)\)
Đúng 0
Bình luận (0)
a)
$n_{CuSO_4} = \dfrac{16}{160} = 0,1(mol)$
$C_{M_{CuSO_4}} = \dfrac{0,1}{0,2} = 0,5M$
b)
$m_{H_2SO_4} = 150.14\% = 21(gam)$
Đúng 1
Bình luận (0)
Hãy tính khối lượng của những lượng chất sau: 0,1 mol Fe; 2,15 mol Cu; 0,8 mol H 2 S O 4 ; 0,5 mol C u S O 4 .