Có 3.6g C tác dụng với 4.48l O2 thu được CO và CO2. Tính % mỗi chất sau phản ứng

Những câu hỏi liên quan
cho 10g hỗn hớp gồm C và S tác dụng với O2 ở nhiệt độ cao, sau phản ứng thu được 11,2 lít hỗn hợp 2 khí CO2 VÀ SO2( ở đktc). Tính khối lượng mỗi chất trong hỗn hợp
\(n_{\text{khí}}=\frac{11,2}{22,4}=0,5mol\)
Đặt \(\hept{\begin{cases}x\left(mol\right)=n_C\\y\left(mol\right)=n_S\end{cases}}\)
\(\rightarrow12x+32y=10\left(1\right)\)
PTHH: \(C+O_2\rightarrow^{t^o}CO_2\)
\(S+O_2\rightarrow^{t^o}SO_2\)
Từ phương trình \(\hept{\begin{cases}n_{CO_2}=n_C=x\left(mol\right)\\n_{SO_2}=n_S=y\left(mol\right)\end{cases}}\)
\(\rightarrow x+y=0,5\left(2\right)\)
Từ (1) và (2) \(\rightarrow\hept{\begin{cases}x=0,3\\y=0,2\end{cases}}\)
\(\rightarrow m_C=12.0,3=3,6g\)
\(\rightarrow m_S=32.0,2=6,4g\)
cho 32g(III) oxit tác dụng với 6,72 lít CO(đktc). Thu được sắt kim loại và khí CO2 a)viết phương trình phản ứng b)chất nào dư sau phản ứng c)tính khối lượng các chất tạo thành sau phản ứng
Bn phải ghi rõ là oxit nào nha.
a. PT: Fe2O3 + 3CO ---> 2Fe + 3CO2.
b. Ta có: \(n_{Fe_2O_3}=\dfrac{32}{160}=0,2\left(mol\right)\)
nCO = \(\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Ta thấy: \(\dfrac{0,2}{1}>\dfrac{0,3}{3}\)
Vậy Fe dư.
c. Theo PT: nFe = 2.nCO = 2 . 0,3 = 0,6(mol)
=> mFe = 0,6 . 56 = 33,6(g)
Theo PT: \(n_{CO_2}=n_{CO}=0,3\left(mol\right)\)
=> \(m_{CO_2}=0,3.44=13,2\left(g\right)\)
Đúng 1
Bình luận (0)
Cho khi mêtan (CH4) tác dụng với ôxi (O2 ), sau phản ứng thu được hơi nước (H2O) và 5,6 lít khí CO2, ở (đktc). a) Viết phương trình phản ứng xảy ra b)Tính khối lượng CH4 tham gia phản ứng c)Thể tích O2 dùng trong phản ứng này là bao nhiêu?
\(n_{CO_2}=\dfrac{5,6}{22,4}=0,25mol\)
\(CH_4+2O_2\rightarrow\left(t^o\right)CO_2+2H_2O\)
0,25 0,5 0,25 ( mol )
\(m_{CH_4}=0,25.16=4g\)
\(V_{O_2}=0,5.22,4=11,2l\)
Đúng 2
Bình luận (0)
Cho 4,48 lít khí SO2 tác dụng với 2,24 lít khí O2. Thêm xúc tác và nung nóng cho phản ứng xảy ra. Sau khi phản ứng kết thúc, ta thu được 5,6 lít hỗn hợp khí gồm SO2, O2, SO3. Tính thể tích mỗi khí có trong hỗn hợp sau phản ứng và tính hiệu suất của phản ứng. Biết các khí đo ở đktc
Gọi hiệu suất phản ứng là a
$2SO_2 + O_2 \xrightarrow{t^o,V_2O_5} 2SO_3$
Ta thấy :
V SO2 / 2 = V O2 nên hiệu suất tính theo số mol của SO2 hoặc O2
V SO2 phản ứng = 4,48a(lít)
V O2 phản ứng = 2,24a(lít)
V SO3 = V SO2 pư = 4,48a(lít)
Sau phản ứng, khí gồm :
SO2 : 4,48 - 4,48a(lít)
O2 : 2,24 - 2,24a(lít)
SO3 : 4,48a(lít)
Suy ra :
4,48 - 4,48a + 2,24 - 2,24a + 4,48a = 5,6
=> a = 0,5 = 50%
Hỗn hợp khí gồm :
SO2 : 4,48 -4,48.0,5 = 2,24 lít
O2 : 2,24 - 2,24.0,5 = 1,12 lít
SO3 : 4,48.0,5 = 2,24 lít
Đúng 1
Bình luận (3)
Cho 16 gam Fe2O3 tác dụng với 3,36 lít khí CO, nung nóng. Sau khi phản ứng xảy ra hoàn toàn thu được m gam chất rắn. Tính m. (Biết: Fe2O3 + CO ---> Fe + CO2).
\(n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right);n_{CO}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ Fe_2O_3+3CO\rightarrow\left(t^o\right)2Fe+3CO_2\\ V\text{ì}:\dfrac{0,1}{1}>\dfrac{0,15}{3}\Rightarrow Fe_2O_3d\text{ư}\\ n_{Fe_2O_3\left(d\text{ư}\right)}=0,1-\dfrac{0,15}{3}=0,05\left(mol\right)\\ n_{Fe}=\dfrac{2}{3}.0,15=0,1\left(mol\right)\\ m=m_{r\text{ắn}}=m_{Fe_2O_3\left(d\text{ư}\right)}+m_{Fe}=0,05.160+0,1.56=13,6\left(g\right)\)
Đúng 2
Bình luận (0)
a) Cacbon oxit CO tác dụng với khí oxi tạo ra cacbon đioxit. Hãy viết phương trình hóa học. b) Nếu muốn đốt cháy 20 mol CO thì phải dùng bao nhiêu mol O2 để sau phản ứng người ta chỉ thu được một chất khí duy nhất? c) Hãy điền vào những ô trống số mol các chất phản ứng và sản phẩm có ở những thời điểm khác nhau. Biết hỗn hợp CO và O2 ban đầu được lấy đúng tỉ lệ về số mol các chất theo phương trình hóa học.
Đọc tiếp
a) Cacbon oxit CO tác dụng với khí oxi tạo ra cacbon đioxit. Hãy viết phương trình hóa học.
b) Nếu muốn đốt cháy 20 mol CO thì phải dùng bao nhiêu mol O2 để sau phản ứng người ta chỉ thu được một chất khí duy nhất?
c) Hãy điền vào những ô trống số mol các chất phản ứng và sản phẩm có ở những thời điểm khác nhau. Biết hỗn hợp CO và O2 ban đầu được lấy đúng tỉ lệ về số mol các chất theo phương trình hóa học.
a) Phương trình phản ứng:
2CO + O2 → 2CO2
b) Theo phương trình 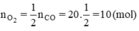
c) Hoàn chỉnh bảng
Thời điểm t1 nCO còn 15mol ⇒ nCO đã phản ứng = 20 - 15= 5mol
Theo pt nCO2 = nCO(pư) = 5 mol
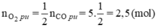 ⇒ nO2 còn lại = 10 - 2,5 = 7,5 mol
⇒ nO2 còn lại = 10 - 2,5 = 7,5 mol
Tương tự tính thời điểm t2 và thời điểm t3 ta được số liệu sau:
| Số mol | |||
| Các thời điểm | Các chất phản ứng | Sản phẩm | |
| CO | O2 | CO2 | |
| Thời điểm ban đầu t0 | 20 | 10 | 0 |
| Thời điểm t1 | 15 | 7,5 | 5 |
| Thời điểm t2 | 3 | 1,5 | 17 |
| Thời điểm kết thúc t3 | 0 | 0 | 20 |
Đúng 1
Bình luận (0)
cho 11 2 gam fe tác dụng với 6,72 o2 thu được oxit sắt từ . a) sau phản ứng chất nào hết ? chất nào dư ?tính khối lượng chất dư . b) tính khối lượng oxit sắt từ thu được sau phản ứng
3Fe + 2O2 → Fe3O4
Theo pt : 3 2 1 mol
Theo đề bài : 0,2 0,3 0,2/3
a.
Ta có tỉ lệ \(\dfrac{0,2}{3}< \dfrac{0,3}{2}\) nên Fe phản ứng hết , oxi dư số mol sắt từ thu được tính theo Fe
b. nFe3O4 = 0,2/3 mol ==> m Fe3O4 = 0,2 /3 .232 = 15,47 gam
Đúng 0
Bình luận (0)
Bài 1: Nung nóng 126,4 gam thuốc tím ở nhiệt độ cao sau phản ứng thu được 7,168 lít O2 (ở đktc). a/ Tính hiệu suất phản ứng. b/ Cho oxi thu được ở trên tác dụng với 24 gam Mg sau phản ứng thu được magie oxit. -Chất nào còn dư sau phản ứng và dư khối lượng bao nhiêu? -Tính khối lượng magie oxit tạo thành bằng nhiều cách. -Tính % mỗi chất có trong hỗn hợp sau phản ứng.
Cho 4,48 lít khí CO (đktc) tác dụng với FeO ở nhiệt độ cao. Sau phản ứng thu được chất rắn A có khối lượng nhỏ hơn 1,6g so với lượng FeO ban đầu. Tính khối lượng Fe thu được và % V các chất (cùng trạng thái) sau phản ứng?
$FeO + CO \xrightarrow{t^o} Fe + CO_2$
Theo PTHH : $n_{FeO} = n_{CO\ pư} = n_{Fe} = n_{CO_2} = a(mol)$
$\Rightarrow m_{giảm} = m_{FeO} - m_{Fe} = 72a -56a = 16a = 1,6(gam)$
$\Rightarrow a = 0,1(mol)$
$m_{Fe} = 0,1.56 = 5,6(gam)$
$n_{CO\ dư} = 0,2 - 0,1 = 0,1(mol)$
$\%V_{CO\ dư} = \%V_{CO_2} = \dfrac{0,1}{0,1 + 0,1}.100\% = 50\%$
Đúng 0
Bình luận (1)



























