Tính lượng natri hidroxit thu được khi cho natri tác dụng với nước: 0,3mol natri

Những câu hỏi liên quan
Tính lượng natri hidroxit thu được khi cho natri tác dụng với nước: 46g natri
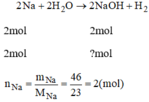
Theo pt n N a O H = n N a = 2 mol ⇒ m N a O H = n.M = 2 .40 = 80g
Đúng 0
Bình luận (0)
tính lượng natri hidroxit thu được khi cho những lượng natri sau tác dụng với nước a, 46g natr b, 0,3 mol natri
a;
2Na + 2H2O \(\rightarrow\)2NaOH + H2
nNa=\(\dfrac{46}{23}=2\left(mol\right)\)
Theo PTHH ta có:
nNa=nNaOH=2(mol)
mNaOH=40.2=80(g)
b;
Theo PTHH ta có:
nNa=nNaOH=0,3(mol)
mNaOH=40.0,3=12(g)
Đúng 0
Bình luận (0)
Cho 20 gam sắt III sunfat
F
e
2
S
O
4
3
tác dụng với natri hidroxit NaOH, thu được 10,7 gam sắt III hidroxit
F
e
(
O
H
)
3
và 21,3 gam natri sunfat
N
a
2
S
O
4
. Xác định...
Đọc tiếp
Cho 20 gam sắt III sunfat F e 2 S O 4 3 tác dụng với natri hidroxit NaOH, thu được 10,7 gam sắt III hidroxit F e ( O H ) 3 và 21,3 gam natri sunfat N a 2 S O 4 . Xác định khối lượng natri hidroxit tham gia vào phản ứng.
Sơ đồ
Sắt (III) sunfat + Natri hidroxit → Sắt (III) hidroxit + natri sunfat
Áp dụng ĐLBTKL, ta có
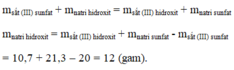
Đúng 0
Bình luận (0)
cho phản ứng hóa học sau .cho kim loại natri tác dụng với nước tạo ra natri hidroxit và khí hidro
a, lập PTHH
b, tính khối lượng của natri tham gia phản ứng nếu khối lượng của nước , natri hidroxit và khí hidro trong phản ứng trên lần lượt là 36g ,80g,3g
a) PTHH: 2 Na + 2 H2O -> 2 NaOH + H2
b) Theo Định luật bảo toàn khối lượng, ta có:
mNa+mH2O=mNaOH +mH2
<=> mNa+ 36=80+3
<=>mNa= 47(g)
(Thật ram em xem lại nha, tính toán thì ra 47 gam, nhưng thực tế mà nói thì anh nghĩ ra 46 gam và 2 gam nước, coi lại chỗ KL nước he)
Đúng 1
Bình luận (0)
\(Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\)
\(b.\)
Bảo toàn khối lượng :
\(m_{Na}=80+3-36=47\left(g\right)\)
Đúng 0
Bình luận (0)
cho 20 gam natri oxit Na2O tác dụng với nước, thu được 0,5 lit dung dịch natri hidroxit NaOH A. viết phương trình hóa học xảy ra B. Tính nồng độ mol của dung dịch bazơ thu được
a) Khi cho Na2O xảy ra phản ứng, tạo thành phản ứng dung dịch có chất tan là NaOH.
Na2O + H2O → 2NaOH
Phản ứng: 0,3 → 0,6 (mol)
CM, NaOH = 0,6/0,5= 1,2M.
Đúng 1
Bình luận (0)
a)2Na2O+2h2O->4NaOH
b)nNaOH=V/22.4=0,5.22.4=11,2mol
Đúng 0
Bình luận (1)
Cho kim loại Natri tác dụng với nước,thu được 11,2 lít khí hidro(ở đktc).
a)Lập phương trình hoá học của phản ứng hoá học trên.
b)Tính khối lượng của Natri hidroxit tạo thành.
c)Nếu đốt lượng khí hidro trên thì cần bao nhiêu lít không khí.Biết rằng thể tích khí õi chiếm 1/5 thể tích không khí.
\(n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
PTHH :
\(2Na+2H_2O\rightarrow2NaOH+H_2\uparrow\)
1 0,5
\(b,m_{NaOH}=1.40=40\left(g\right)\)
\(c,H_2+O_2\underrightarrow{t^o}2H_2O\)
0,5 0,5
\(V_{O_2}=0,5.22,4=11,2\left(l\right)\)
\(V_{kk}=11,2.5=56\left(l\right)\)
Đúng 2
Bình luận (1)
hòa tan 4,6g natri vào 1,8g nước thu được 8g natri hidroxit và khí hidro tính khối lượng khí hiddro thu được
- 2Na + 2H2O -----> 2NaOH + H2
- Áp dụng định luật BTKL được :
mH2O = mNaOH + mH2 - mNa = 8 + 0,2 - 4,6 = 3,6 (g)
Đúng 1
Bình luận (0)
: Cho 2,3 gam natri tác dụng hết với 100 gam nước thu được dung dịch natri hiđroxit và thoát ra 0,1 gam khí hiđro.
a) Viết phương trình hóa học xảy ra.
b) Tính khối lượng dung dịch natri hiđroxit thu được.
\(Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\)
Bảo toàn khối lượng :
\(m_{Na}+m_{H_2O}=m_{NaOH}+m_{H_2}\)
\(m_{NaOH}=2.3+100-0.1=102.2\left(g\right)\)
Đúng 1
Bình luận (0)
Dẫn khí Clo vào dung dịch chứa 44,8(g0 Natri hidroxit vừa đủ thu được Natri Clorua , Natri hipoclorit ( NaCLO) và Nước . Tính khối lượng Muối ăn thu được bằng 2 cách
Cl2 + 2NaOH → NaCl + NaClO + H2O
nNaOH = \(\dfrac{44,8}{40}\)= 1,12 mol.
=> nNaCl = \(\dfrac{1,12}{2}\)= 0,56 <=> mNaCl = 0,56.58,5 = 32,76 gam
Cách 2: Áp dụng ĐLBT khối lượng => mNaCl = mCl2 + mNaOH - mNaClO- mH2 = 0,56.71 + 1,12.40 - 0,56. 74,5 - 0,56.18 = 32,76 gam
Đúng 1
Bình luận (0)





















