Ion Y - có cấu hình electron là: 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 . Vị trí của Y trong bảng tuần hoàn là
A. Chu kì 3, nhóm VIIA.
B. Chu kì 3, nhóm VIIIA
C. Chu kì 4, nhóm IA.
D. Chu kì 4, nhóm IIA.
Từ cấu hình e của ion viết cấu hình e của nguyên tử
a. Ion A+, B2+, D3+, X-, Y2-, Z3- đều có cấu hình electron là: 1s22s22p6. Viết cấu hình của A,
B, D, X, Y, Z.
b. Ion A+, B2+, X-, Y2-, Z3- đều có cấu hình electron là: 1s22s22p63s23p6. Viết cấu hình của
A, B, X, Y, Z
Một nguyên tử X có 26 electron. Khi mất 2 electron, cấu hình electron của ion X 2 + là
A. [ A r ] 3 d 4 4 s 2
B. [ A r ] 3 d 5 4 s 1
C. [ A r ] 3 d 6
D. [ A r ] 3 d 5
C
Cấu hình electron của X là: [ A r ] 3 d 6 4 s 2
Khi mất electron, nguyên tử sẽ mất electron lần lượt từ phân lớp ngoài vào trong.
Cấu hình electron của X 2 + là: [ A r ] 3 d 6
X và Y đều là hợp chất ion cấu tạo thành từ các ion có chung cấu hình electron 1s22s22p6. Tổng số hạt proton, nơtron, electron trong phân tử X và Y lần lượt là 92 và 60. X và Y lần lượt là :
A.MgO; MgF2
B. MgF2 hoặc Na2O; MgO
C. Na2O; MgO hoặc MgF2
D. MgO; Na2O.
Đáp án B
Anion có cấu hình1s22s22p6 => Anion là F hoặc O
Cation có cấu hình1s22s22p6 => Cation là Na hoặc Mg
Nếu anion là O, tổng số hạt p,n,e trong X là 92, X là Na2O (2pNa + nNa) + (2pO + nO) = 92
Tổng số hạt trong Y là 60, vậy Y là MgO.
Nếu anion là F.
Tổng số hạt trong X là 92. X là MgF2
X và Y đều là hợp chất ion cấu tạo thành từ các ion có chung cấu hình electron 1s22s22p6. Tổng số hạt proton, nơtron, electron trong phân tử X và Y lần lượt là 92 và 60. X và Y lần lượt là :
A. MgO; MgF2
B. MgF2 hoặc Na2O; MgO
C. Na2O; MgO hoặc MgF2
D. MgO; Na2O.
Đáp án B
![]()
![]()
![]()
![]()
- Giả sử anion là O
+ Tổng số hạt p, n, e trong phân tử X là 92. =>X là Na2O (2 × (11 × 2 + 12) + (8 × 2 + 8) = 92).
+ Tổng số hạt p, n, e trong phân tử Y là 60. =>Y là MgO ((12 × 2 + 12)+ (8 × 2 + 8) = 60).
- Giả sử anion là F
+ Tổng số hạt trong phân tử X là 92. => X là MgF2 ( (12 × 2 + 12) + 2 × (9 × 2 + 10) = 92)
X và Y đều là hợp chất ion cấu tạo thành từ các ion có chung cấu hình electron 1 s 2 2 s 2 2 p 6 . Tổng số hạt proton, nơtron, electron trong phân tử X và Y lần lượt là
92 và 60. X và Y lần lượt là :
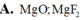
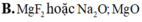
![]()
![]()
nguyên tố y có phân lớp cuối cùng thuộc phân mức năng lượng cao nhất 3d3
a) viết cấu hình electron nguyên tử y và cho biết y thuộc nguyên tố s,p,d hay f
b) y là kim loại phi kim hay khí hiếm giải thích
c) viết cấu hình electron nguyên tử của ion được hình thành từ y
Nguyên tử oxi có cấu hình electron là 1 s 2 2 s 2 2 p 4 . Ion O 2 - có cấu hình electron là
A. 1 s 2 2 s 2 2 p 4 .
B. 1 s 2 2 s 2 2 p 4 3 s 2 .
C. 1 s 2 2 s 2 2 p 6 .
D. 1 s 2 2 s 2 2 p 6 3 s 2 .
Nguyên tử A có cấu hình electron: 1 s 2 2 s 2 2 p 6 3 s 2 3 p 3 . Ion A 3 - có cấu hình electron là
A. 1 s 2 2 s 2 2 p 6 3 s 2 .
B. 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 .
C. 1 s 2 2 s 2 2 p 6 3 s 2 3 p 5 .
D. 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 .
BT1:Viết cấu hình electron của các nguyên tố sau và cho
biết chúng là KL hay PK, viết CH e của ion mà nó có thể tạo ra
S (16), Rb (37), Zn (30), F (9); Mn (25); Mg (12)
BT2: Các ion X2+, Y3+, Z2+ có cấu hình electron lần lượt là
+/ 1s22s22p63s23p63d4 ; +/ 1s22s22p63s23p63d5
; +/ 1s22s22p63s23p63d9 . Hãy viết cấu hình electron của X, Y, Z và KHHH của X, Y, Z.
BT3: Xác định tên nguyên tố X trong các trường hợp sau:
a/ X có 4 e ở lớp N. b/ X có tổng 9 e ở phân lớp p.
c/ X có tổng 7 e ở phân lớp s
Nguyên tử của nguyên tố Y nhận thêm 1 electron thì tạo thành ion Y - có cấu hình electron lớp ngoài cùng là 2 p 6 . Trong hạt nhân của Y có 10 nơtron. Số khối của Y là
A. 19
B. 20
C. 16
D. 9