Cation X + do 5 nguyên tử của 2 nguyên tố hóa học A, B tạo nên. Tổng số proton trong X + là 11. Hai nguyên tố A, B là
A. Li và C
B. Be và N
C. H và C
D. H và N
Cation X+ do 5 nguyên tử của 2 nguyên tố hóa học tạo nên. Tổng số proton trong X+là 11. Công thức của X+ là:
A. NH4+
B. NH3Cl+
C. Al(OH)4-
D. Ba(OH)4+
D. Ba(OH)4+
Đáp án A.
Số proton trung bình của một hạt nhân nguyên tử trong X+ là 11/5= 2,2. Vậy một nguyên tố trong X+ có điện tích hạt nhân nhỏ hơn 2,2, nguyên tố đó là H (Z = 1). Loại trường hợp He (Z = 2) vì He là khí hiếm không tạo được hợp chất. Vậy công thức ion X+có dạng: [A5-nHn]+. Trong đó : (5-n).ZA+ n = 11.Ta lập bảng sau:
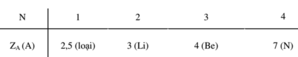
Ta loại các trường hợp A là Li, Be vì các ion X+ tương ứng không tồn tại.
Trường hợp A là nitơ thỏa mãn vì ion amoni tồn tại. Vậy X+là ion NH4+
Câu 1. Hợp chất A được tạo thành từ cation X+ và anion Y2-. Mỗi ion đều do 5 nguyên tử của hai nguyên tố tạo nên. Tổng số proton trong X+ là 11, tổng số electron trong Y2- là 50. Biết rằng hai nguyên tố trong Y2- đều thuộc cùng một nhóm A và thuộc hai chu kì liên tiếp. Phân tử khối của A là
Hợp chất A được tạo thành từ cation X + và anion Y 2 - . Mỗi ion đều do 5 nguyên tử của hai nguyên tố tạo nên. Tổng số proton trong X + là 11, tổng số electron trong Y 2 - là 50. Biết rằng hai nguyên tố trong Y 2 - đều thuộc cùng một nhóm A và thuộc hai chu kì liên tiếp. Phân tử khối của A là
A. 96
B. 78
C. 114
D. 132
D
Xét ion X + : có 5 nguyên tử, tổng số proton là 11. Vậy số proton trung bình là 2,2.
=> Có 1 nguyên tử có số proton nhỏ hoặc bằng 2 và tạo thành hợp chất. Vậy nguyên tử đó là H

Số electron trung bình của các nguyên tử trong Y 2 - là 9,6
=> Có 1 nguyên tử có số electron nhỏ hơn 9,6
=> Nguyên tử của nguyên tố thuộc chu kì 2.
=> Nguyên tử của nguyên tố còn lại thuộc chu kì 3.
Nếu 2 nguyên tố cùng thuộc một nhóm A thì sẽ hơn kém nhau 8 electron

Hợp chất Z được tạo nên từ cation X+ và anion Y-, mỗi ion đều do 5 nguyên tử của 2 nguyên tố phi kim tạo nên. Biết tổng số proton trong X+ là 11 và trong Y- là 47. Hai nguyên tố trong Y3- thuộc 2 chu kỳ kế tiếp nhau trong bảng tuần hoàn và có số thứ tự cách nhau 7 đơn vị. Phát biểu nào sau đây về hợp chất M là sai:
A. Phân tử khối của Z là 1 số lẻ
B. Trong hợp chất Z chỉ chứa hai loại liên kết ion và liên kết cộng hóa trị
C. Z phản ứng được với dung dịch NaOH
D. Hợp chất Z phản ứng được với dung dịch AgNO3 tạo kết tủa màu trắng
Tìm cation X+: Ta sẽ làm một bài hóa nhỏ: “Hợp chất X do 5 nguyên tố phi kim loại tạo nên, biết rằng tổng số proton trong X là 11. Tìm X”
+ Để cho dữ liệu gồm tổng số proton và tổng số nguyên tố tạo nên vì vậy ta sẽ nghĩ ngay đến trị số proton trung bình từ đó ta có: Z ¯ = 11 5 = 2 , 2 ⇒ Phải có 1 nguyên tố có số proton bé hơn 2 Chỉ có thể là H (do He là khí hiếm)
Gọi X là AHy theo giả thiết ta có:
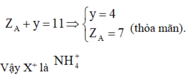
Tìm anion Y3- : Tương tự ta cũng sẽ làm bài hóa nhỏ sau: “Hợp chất Y do 5 nguyên tố phi kim thuộc 2 chu kỳ kế tiếp trong bảng tuần hoàn và có số thứ tự cách nhau 7 đơn vị tạo nên. Biết rằng tổng số proton trong Y là 47. Tìm Y”
Tương tự chúng ta cũng sẽ khai thác trị số proton trung bình:
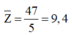
Do đó phải có 1 nguyên tố có số proton nhỏ hơn 9,4 (chu kỳ 2 hoặc 1).
Mặt khác theo giả thiết ta có 2 nguyên tố phi kim tạo nên Y thuộc 2 chu kỳ liên tiếp
=> Hai nguyên tố đó thuộc chu kỳ 2 và chu kỳ 3.
Chu kỳ 3 có các phi kim Si(14); P(15); S(16); 17 (Cl)
Từ đó ta suy ra được các cặp là (Si – N); (P – O); (S – F).
Dễ dàng nhận thấy cặp thỏa mãn là (P – O) với ion P O 4 3 -
Vậy Z là (NH4)3PO4 từ đó ta có:
A: Đúng: Phân tử khối của Z là 133
B: Đúng: Trong Z chỉ chứa liên kết ion (giữa và ) và liên kết cộng hóa trị (giữa N và H; giữa P và O)
C: Đúng: Z chứa ion nên Z phản ứng được với NaOH theo phương trình
![]()
D: Sai: Z phản ứng được với AgNO3 tạo kết tủa Ag3PO4 (màu vàng)
Đáp án D.
Hợp chất M được cấu tạo từ anion Y2- và cation X+. Mỗi ion đều do 5 nguyên tử của 2 nguyên tố tạo thành. Tổng số proton trong X+ là 11, còn tổng số electron trong Y2- là 50. Công thức phân tử của hợp chất M là:
A. (NH4)2CrO4
B. (NH4)2S2O3
C. (NH4)2HPO3
D. (NH4)2SO4
Theo 4 đáp án X+ là NH4+
ion Y 2- có tổng số e là 50 và do 2 nguyên tố tạo thành.
♦ Đáp án A: tổng số e: 24+8.4+2=58 → loại
♦ Đáp án B: tổng số e: 16.2+8.3+2=58 → Loại
♦ Đáp án C: loại do có 3 chất tạo thành
♦ Đáp án D: tổng số e: 16+8.4+2=50 → thỏa mãn
Đáp án D
Anion Y 2 - do 5 nguyên tử của 2 nguyên tố hóa học A, B tạo nên. Tổng số electron trong Y 2 - là 50. Hai nguyên tố A, B là
A. C và O
B. C và N
C. O và Cl
D. O và S
Chọn D

Vậy trong Y có 1 nguyên tố có Z < 9,6 một nguyên tố có Z > 9,6.
→ Loại A và B vì các nguyên tố trong A và B đều có Z < 9,6.
→ Anion có dạng XmO5 – m. Trong đó: m.Zx + 8.(5 – m) = 48.
Vậy m = 1; Zx = 16 thỏa mãn. Y2- là SO42-.
Lập công thức hóa học của hợp chất tạo nên bởi hai nguyên tố X và Y. Biết X có số proton bằng 11 và Y có nguyên tử khối là 35,5.
A. NaCl
B. B a C l 2
C. N a 2 O
D. M g C l 2
Đáp án A
X có số proton bằng 11 nên X là Na (có hóa trị I);
Y có nguyên tử khối bằng 35,5 nên là Cl.
1 hợp chất A có phân tử gồm 2 nguyên tử X và 1 nguyên tử Y. Biết rằng tổng số proton trong phân tử là 46. Số proton của nguyên tử X hơn số proton của nguyên tử Y là 11 hạt.a) Xác định X,Y thuộc nguyên tố hóa học nào? Viết CTHH của hợp chất A. b)Tình khối lượng theo gam của 10 phân tử X2Y, bieetv 1 Dvc=1,6605*10^-23 gam
Tổng số hạt proton, nơtron, electron tạo nên nguyên tử nguyên tố X là 48, trong đó số hạt mang điện dương bằng số hạt không mang điện.Tính số hạt p,n,e và viết tên kí hiệu hóa học của nguyên tố?
Gọi số hạt prton, electron và nơtron của X là p,e,n
Vì p=e⇒ p+e=2p
Theo đề ta có hệ pt: \(\left\{{}\begin{matrix}\text{2p+n=48}\\p=n\end{matrix}\right.\)
⇔\(\left\{{}\begin{matrix}p=16\\n=16\\e=16\end{matrix}\right.\)
Vậy số hạt proton, electron, nơtron trong X là : 16,16,16