Nêu nguyên tắc của việc điều chế khí Cl2 trong phòng thí nghiệm. Viết PTHH của 5 phản ứng minh hoạ.

Những câu hỏi liên quan
Nêu tính chất hoá học, nguyên liệu điều chế hidro trong phòng thí nghiệm. Viết PTHH minh hoạ.
Nêu tính chất hoá học, nguyên liệu điều chế hidro trong phòng thí nghiệm. Viết PTHH minh hoạ.
- Tính chất hoá học:
+ Phản ứng với O2 ---> nước: \(2H_2+O_2\underrightarrow{t^o}2H_2O\)
+ Phản ứng với phi kim ---> hợp chất khí (axit không có oxi):
\(H_2+Cl_2\underrightarrow{\text{ánh sáng}}2HCl\)
\(H_2+S\underrightarrow{t^o}H_2S\)
+ Phản ứng với oxit kim loại (đứng sau Al) ---> kim loại + nước:
\(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\\ Ag_2O+H_2\underrightarrow{t^o}2Ag+H_2O\)
- Điều chế:
+ Nguyên liệu: Mg, Al, Pb, Zn, Fe, HCl, H2SO4 (loãng),...
+ Phương pháp: cho kim loại + axit ---> muối + H2
\(Mg+2HCl\rightarrow MgCl_2+H_2\\ 2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ Zn+2HCl\rightarrow ZnCl_2+H_2\\ Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
Đúng 2
Bình luận (0)
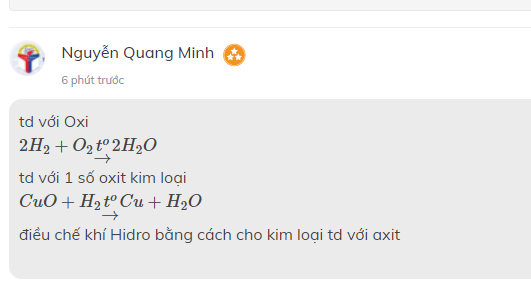
td với Oxi
\(2H_2+O_2\underrightarrow{t^o}2H_2O\)
td với 1 số oxit kim loại
\(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
điều chế khí Hidro bằng cách cho kim loại td với axit
Đúng 3
Bình luận (0)
nêu phương pháp và vẽ hình thí nghiệm điều chế H2 trong phòng thí ngiệm. Nêu các cách thu khí vào bình và giải thích, Viết PTHH phản ứng ?

Dựa vào tính chất H2 tan rất ít trong nước.
PTHH:
Fe + H2SO4 -> FeSO4 + H2
Fe + 2HCl -> FeCl2 + H2
Zn + H2SO4 -> ZnSO4 + H2
Zn + 2HCl -> ZnCl2 + H2
2Al + 3H2SO4 -> Al2(SO4)3 + 3H2
2Al + 6HCl -> 2AlCl3 + 3H2
Đúng 3
Bình luận (0)
Nêu nguyên liệu dùng để điều chế oxi, hidro trong phòng thí nghiệm. Viết pthh minh họa? Nguyên liệu dùng để điều chế oxi trong phòng thí nghiệm phải có đặc điểm gì? Không khí có thành phần như thế nào? Có thể thu khí oxi và hidro bằng những cách nào, tại sao?
Đọc tiếp
Nêu nguyên liệu dùng để điều chế oxi, hidro trong phòng thí nghiệm. Viết pthh minh họa? Nguyên liệu dùng để điều chế oxi trong phòng thí nghiệm phải có đặc điểm gì? Không khí có thành phần như thế nào? Có thể thu khí oxi và hidro bằng những cách nào, tại sao?
trong phòng thí nghiệm , người ta đốt cháy sắt trong bình đựng khí oxi để điều chế 2,32g oxit sắt từ a) viết pthh của phản ứng ? phản ứng thuộc loại nào? giải thích b)tính thể tích khí oxi cần dùng ở ( đktc) cho phản ứng trên ? c) tính % theo khối lượng của nguyên tố sắt có trong oxit sắt từ?
nFe3O4 = 2,32 : 232 = 0,1 (mol)
pthh : 3Fe + 2O2 -t--> Fe3O4 (phản ứng hóa hợp )(có 2 chất sinh ra 1 chất mới)
0,3 <-- 0,2 < ------------0,1(mol)
=> VO2 = 0,2 . 22,4 = 4,48 (l)
%mFe = 168 .100 / 232 = 72,4 %
Đúng 1
Bình luận (0)
a) Nêu tính chất hóa học của oxi , hidro . mỗi tính chất cho 2 puhh minh họa
b) Nêu nguyên liệu , viết pthh điều chế khí o2 , h2 trong phòng thí nghiệm
giúp e với ạ ,e cảm ơn
a) bạn tự học SGK
b) Nguyên liệu điều chế O2: KMnO4, KClO3, KNO3 (độc), H2O,...
2KMnO4 -> (t°) K2MnO4 + MnO2 + O2
2KClO3 -> (t°, MnO2) 2KCl + 3O2
2KNO3 -> (t°) 2KNO2 + O2
2H2O -> (đp) 2H2 + O2
Nguyên liệu điều chế H2: Pb, Zn, Fe, Al, HCl, H2SO4 loãng,...
Fe + 2HCl -> FeCl2 + H2
2Al + 3H2SO4 ->
Al2(SO4)3 + 3H2
2H2O -> (đp) 2H2 + O2
Đúng 5
Bình luận (0)
Trong phòng thí nghiệm có các hóa chất KClO3 , MnO2 và dụng cụ cần thiết
a, Viết phương trình hóa học của phản ứng điều chế khí oxi
b, Hãy vẽ hình mô tả thí nghiệm điều chế và thu khí oxi bằng cách đẩy không khí
a) 2KClO3 -> 2KCl + 3O2
b) MnO2 + 4HCl -> MnCl2 + Cl2 + 2H2O
b) SGK
Đúng 0
Bình luận (1)
a) Trình bày thí nghiệm điều chế H2 trong phòng thí nghiệm. Viết phương trình phản ứng (nếu có)?
b) Trình bày thí nghiệm điều chế O2 trong phòng thí nghiệm. Viết phương trình phản ứng (nếu có)?
a. – Trong phòng thí nghiệm để điều chế H2 thường sử dụng axit HCl (hoặc H2SO4 loãng) và kim loại Zn (hoặc Fe, hoặc Al).
Zn + 2HCl → ZnCl2 + H2↑
– Khí H2 ít tan trong nước và nhẹ hơn không khí nên ta có thể thu H2 theo 2 cách: Đẩy nước và đẩy không khí.
b. – Trong phòng thí nghiệm, người ta điều chế khí oxi bằng cách đun nóng những hợp chất giàu oxi và dễ phân hủy ở nhiệt độ cao.
2KMnO4 ---t° → K2MnO4 + MnO2 + O2
2KClO3 ---t° → 2KCl + 3O2
– Khí O2 ít tan trong nước và nặng hơn không khí nên ta có thể thu O2 theo 2 cách: Đẩy nước và đẩy không khí.
Đúng 0
Bình luận (0)
1. Nêu tính chất hóa học của oxi, hiđro. Viết phương trình hóa học minh họa.
2. Viết PTHH để điều chế H2, O2 trong phòng thí nghiệm.
3. Nêu khái niệm, cách gọi tên, phân loại oxit. Lấy ví dụ minh họa.
4. Nêu tên, khái niệm, ví dụ về các loại phản ứng hóa học đã học.
5. Nêu ứng dụng của oxi, hiđro.