Thực hiện phản ứng nhiệt nhôm 0,35 mol Al với 0,3 mol Fe 2 O 3 thu được 0,2 mol Fe. Hiệu suất của phản ứng là
A. 66,67%
B. 57,14%
C. 83,33%
D. 68,25%
Thực hiện phản ứng nhiệt nhôm với 0,35 mol Al với 0,3 mol Fe2O3 thu được 0,2 mol Fe. Hiệu suất phản ứng là:
A. 57,14%
B. 83,33%
C. 68,25%
D. 66,67%
Đáp án A
2 Al + Fe 2 O 3 → t o Al 2 O 3 + 2 Fe
Vì hệ số của Al và Fe2O3 trong phương trình lần lượt là 2 và 1. Mặt khác
n Al = 0 , 35 ; n Fe 2 O 3 = 0 , 3
Nên nếu H = 100% thì Al là chất hết trước. Do đó H được tính theo số mol Al.
Nếu H = 100% thì nF = nA1 =0,35
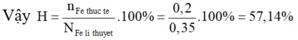
Thực hiện phản ứng nhiệt nhôm từ 0,25 mol Al và 0,35 mol FeO thì thu được 0,3 mol Fe. Hiệu suất phản ứng nhiệt nhôm là:
A. 80,00%
B. 83,33%
C. 85,71%
D. Kết quả khác
Thực hiện phản ứng nhiệt nhôm 0,4 mol Al với 0,15 mol Fe 2 O 3 thu được 0,2 mol Fe. Hiệu suất của phản ứng là
A. 66,67%
B. 57,14%
C. 83,33%
D. 68,25%
Trộn 0,25 mol bột Al với 0,15 mol bột Fe 2 O 3 rồi tiến hành phản ứng nhiệt nhôm trong điều kiện không có không khí (giả sử chỉ có phản ứng khử Fe 2 O 3 về Fe) thu được hỗn hợp rắn X. Cho X tác dụng với dung dịch NaOH (dư) thu được dung dịch Y, m gam chất rắn khan Z và 0,15 mol H 2 . Hiệu suất phản ứng nhiệt nhôm và giá trị của m lần lượt là
A. 60% và 20,40
B. 60% và 30,75
C. 50% và 20,75
D. 50% và 40,80
Trộn 0,1 mol bột Al với 0,06 mol bột Fe 2 O 3 rồi tiến hành phản ứng nhiệt nhôm trong điều kiện không có không khí (giả sử chỉ có phản ứng khử Fe 2 O 3 về Fe) thu được hỗn hợp rắn X. Cho X tác dụng với dung dịch NaOH (dư) thu được dung dịch Y, m gam chất rắn khan Z và 0,03 mol H 2 . Hiệu suất phản ứng nhiệt nhôm và giá trị của m lần lượt là
A. 60% và 8,64 gam
A. 60% và 8,64 gam
C. 80% và 7,68 gam
D. 80% và 8,64 gam
Trộn 0,25 mol bột Al với 0,15 mol bột Fe2O3 rồi tiến hành phản ứng nhiệt nhôm trong điều kiện không có không khí (giả sử chỉ có phản ứng khử Fe2O3 về Fe) thu được hỗn hợp rắn X. Cho X tác dụng với dung dịch NaOH (dư) thu được dung dịch Y, m gam chất rắn khan Z và 0,15 mol H2. Hiệu suất phản ứng nhiệt nhôm và giá trị của m lần lượt là
A. 60% và 20,40
B. 60% và 30,75
C. 50% và 20,75
D. 50% và 40,80
Đáp án A
n Al dư = 2nH2 / 3 = 0,1 mol
⇒ H = (0,25 – 0,1)/0,25 .100%= 60%
2Al + Fe2O3 → Al2O3 +2Fe
0,15
⇒ mZ = 160.(0,15 – 0,075) + 56.0,15 = 20,4 g
Trộn 5,4 gam bột Al với 17,4 gam bột Fe3O4 rồi tiến hành phản ứng nhiệt nhôm (trong điều kiện không có không khí). Giả sử chỉ xảy ra phản ứng khử Fe3O4 thành Fe. Hòa tan hoàn toàn chất rắn sau phản ứng bằng dung dịch H2SO4 loãng (dư) thu được 5,376 lít khí H2 (ở đktc). Hiệu suất phản ứng nhiệt nhôm và số mol H2SO4 đã phản ứng là:
A. 75 % và 0,54 mol
B. 80 % và 0,52 mol
C. 75 % và 0,52 mol
D. 80 % và 0,54 mol
Đáp án D
nAl = 0,2 mol ; nFe3O4 = 0,075 mol ; nH2 = 0,24 mol
Phản ứng xảy ra không hoàn toàn:
8Al + 3Fe3O4 → 4Al2O3 + 9Fe
x 0,5x (mol)
Hòa tan chất rắn (Fe, Al dư) vào H2SO4 ⇒H2
BT e ta có: 2.nFe + 3.nAl = 2.nH2
⇒ 9/8.x.2 + (0,2 – x).3 = 0,24.2 ⇒ x = 0,16 mol ⇒ Hphản ứng = 0,16/0,2 = 80%
BT e ⇒nH+phản ứng = 2.nFe + 3.nAl + 6.nAl2O3 + 8.nFe3O4 = 0,36 + 0,12 + 0,48 + 0,12 = 1,08 mol
⇒ nH2SO4phản ứng = 1,08/2 = 0,54mol
Cho 1 mol Fe, 0,6 mol Zn tác dụng hết với dung dịch HNO3, sau phản ứng chỉ thu được dung dịch A (chỉ chứa 2 muối) và hỗn hợp khí G gồm ( 0,1 mol N2, 0,2 mol NO, 0,2 mol NO2, 0,3 mol N2O). Số mol HNO3 tham gia phản ứng là
Muối sau pư gồm \(\left\{{}\begin{matrix}Fe\left(NO_3\right)_3:1\left(mol\right)\\Zn\left(NO_3\right)_2:0,6\left(mol\right)\end{matrix}\right.\)
Bảo toàn N: nHNO3 = 5,4 (mol)
hử hoàn toàn một oxit sắt chưa biết (FexOy) bằng nhôm thu được 0,2 mol nhôm oxit và 0,4 mol mol sắt theo sơ đồ phản ứng sau: FexOy + Al ----> Fe + Al2O3. Công thức oxit sắt là: *
$3Fe_xO_y + 2yAl \xrightarrow{t^o} 3xFe +y Al_2O_3$
Theo PTHH :
$n_{Fe} = \dfrac{3x}{y}n_{Al_2O_3}$
$\Rightarrow 0,4 = \dfrac{3x}{y}.0,2$
$\Rightarrow \dfrac{x}{y} = \dfrac{2}{3}$
Vậy oxit là $Fe_2O_3$