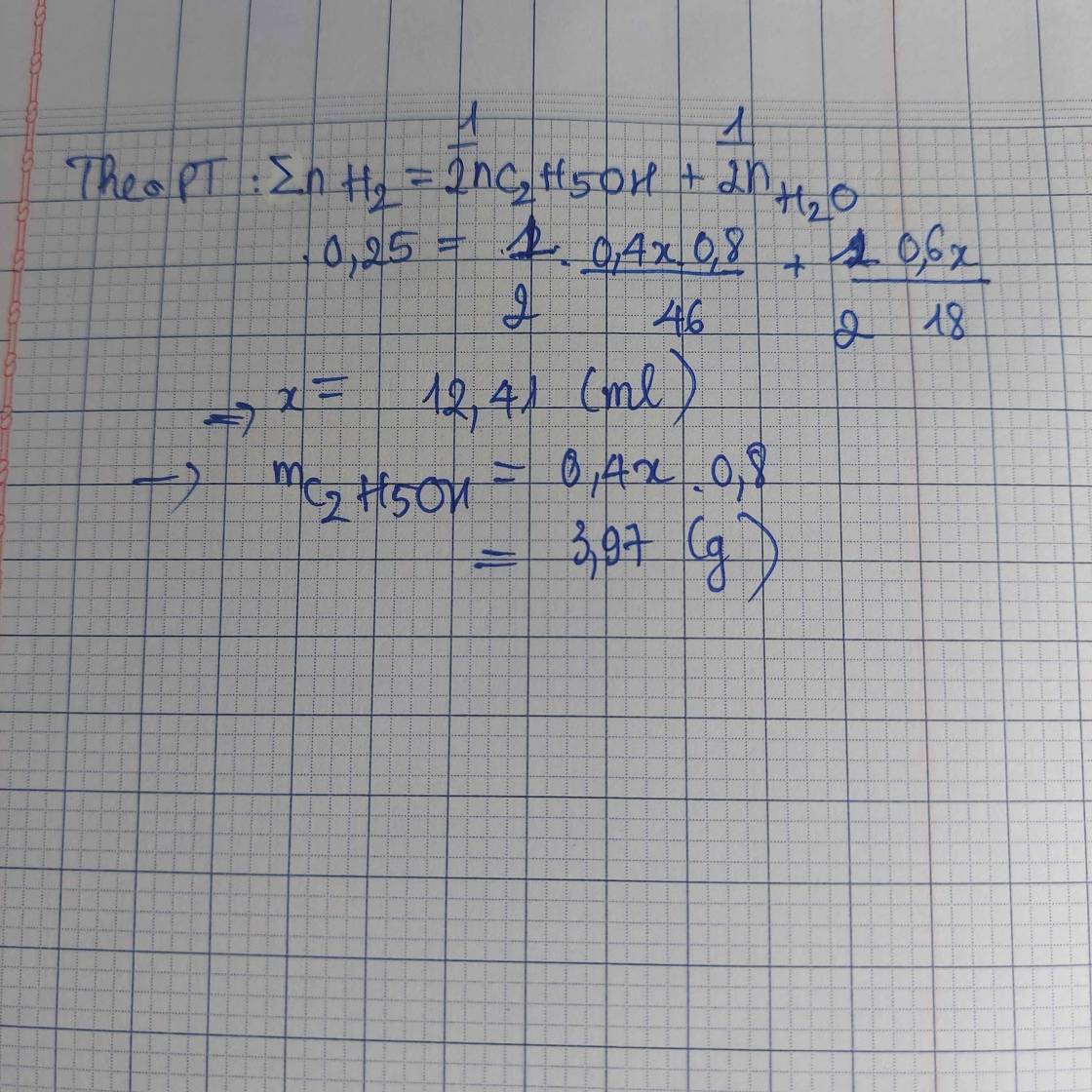Cho Natri dư tác dụng với 50ml C2H5OH 40o. Tính thể tích khí H2( đktc).

Những câu hỏi liên quan
Cho 23 gam rượu etylic nguyên chất tác dụng với natri dư. Thể tích khí H 2 thoát ra (đktc) là
A. 2,8 lít.
B. 5,6 lít.
C. 8,4 lít.
D. 11,2 lít.
Đáp án: B
n C 2 H 5 O H = 23 46 = 0 , 5 m o l
2 C 2 H 5 O H + 2 N a → 2 C 2 H 5 O N a + H 2 ↑
0,5 mol → 0,25 mol
⇒ V H 2 = 0 , 25 . 22 , 4 = 5 , 6
Đúng 0
Bình luận (0)
Cho 20,2 gam rượu tác dụng với Na lấy dư thấy thoát ra 5,6 lít khí H2 (đktc)
a. Xác định độ rượu?
b. Nếu dùng rượu etylic 40o cho tác dụng với Na thì cần bao nhiêu gam rượu để thu được thể tích H2 nói trên?
a. Cho 14 gam rượu etylic tác dụng với Natri (dư)
b. Tính khối lượng sản phẩm
c. Tính thể tích khí H2(đktc).
giải ra rõ ràng giúp mình ạ, mình cảm ơn
\(n_{C_2H_5OH}=\dfrac{14}{46}=\dfrac{7}{23}\left(mol\right)\)
\(C_2H_5OH+Na\rightarrow C_2H_5ONa+\dfrac{1}{2}H_2\)
\(\dfrac{7}{23}...................\dfrac{7}{23}......\dfrac{7}{46}\)
\(m_{C_2H_5ONa}=\dfrac{7}{23}\cdot68=20.7\left(g\right)\)
\(V_{H_2}=\dfrac{7}{46}\cdot22.4=3.4\left(l\right)\)
Đúng 2
Bình luận (0)
\(a) 2C_2H_5OH + 2Na \to 2C_2H_5ONa + H_2\\ n_{C_2H_5ONa} = n_{C_2H_5OH} = \dfrac{14}{46} = \dfrac{7}{23}(mol)\\ m_{C_2H_5ONa} = \dfrac{7}{23}.68 = 20,7(gam)\\ n_{H_2} = \dfrac{1}{2}n_{C_2H_5OH} = \dfrac{7}{46}(mol)\\ m_{H_2} = \dfrac{7}{46}.2 = \dfrac{7}{23}(gam)\\ b) V_{H_2} = \dfrac{7}{46}.22,4 = 3,41(lít)\)
Đúng 2
Bình luận (0)
13/ Cho 16,8g sắt tác dụng với dung dịch HCl dư. Tính thể tích khí H2 thu được ở đktc.
14/ Cho 25g CaCO3 vào dung dịch HCl dư. Tính thể tích khí CO2 thu được (ở đktc).
15/ Cho 16 g hỗn hợp hai kim loại Fe và Mg tác dụng hoàn toàn với dung dịch HCl dư, sinh ra 6,72 lít khí H2 (đktc). Tính khối lượng mỗi kim loại trong hỗn hợp ban đầu.
\(13,n_{Fe}=\dfrac{16,8}{56}=0,3\left(mol\right)\\ PTHH:Fe+2HCl\rightarrow FeCl_2+H_2\\ .....0,3.....0,6......0,3......0,3\left(mol\right)\\ V_{H_2\left(đktc\right)}=0,3\cdot22,4=6,72\left(l\right)\\ 14,n_{CaCO_3}=\dfrac{25}{40+12+16\cdot3}=0,25\left(mol\right)\\ PTHH:CaCO_3+2HCl\rightarrow CaCl_2+H_2O+CO_2\\ .....0,25.....0,5......0,25......0,25......0,25\left(mol\right)\\ V_{CO_2\left(đktc\right)}=0,25\cdot22,4=5,6\left(l\right)\)
Đúng 1
Bình luận (0)
4/ Hỗn hợp A gồm phenol C6H5OH và etanol. Cho mg A tác dụng với Na dư, thu được 12,6g muối và V lít khí H2 ( đktc). Mặt khác, m gam A tác dụng vừa đủ với 50ml dd KOH 1M. Tính V ?
Gọi số mol của C6H5OH và C2H5OH trong m gam A lần lượt là x và y.
Khi cho m gam A tác dụng vừa đủ với KOH thì chỉ phenol phản ứng
C6H5OH + KOH → C6H5OK + H2O
=> nC6H5OH = nKOH = 0,05.1 = 0,05 mol
Khi m gam A phản ứng với Na dư:
C6H5OH + Na → C6H5ONa + 1/2H2
C2H5OH + Na → C2H5ONa + 1/2H2
mMuối = mC6H5ONa + mC2H5ONa = 0,05.116 + 68y = 12,6
=> y = 0,1 mol
=> nH2 = (0,05 + 0,1):2 = 0,075 mol
<=> V H2 = 0,075.22,4 = 1,68 lít
Đúng 0
Bình luận (0)
Khi cho 5,30 gam hỗn hợp gồm etanol C2H5OH và propan-1-ol CH3CH2CH2OH tác dụng với natri (dư) thu được 1,12 lít khí (đktc).Tính thành phần phần trăm khối lượng của mỗi chất trong hỗn hợp.
Gọi số mol của etanol là x của propan-1-ol là y (mol)
Theo (1) và (2) ta có hệ phương trình:
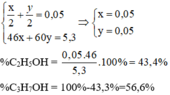
Đúng 0
Bình luận (0)
Cho một hỗn hợp chứa 2,3 g natri và 7,8 g kali tác dụng hết với nước .thể tích khí H2 thu được ở đktc là :
nNa=2,3/23=0,1(mol); nK=7,8/39=0,2(mol)
PTHH: Na + H2O -> NaOH + 1/2 H2
0,1_______________________0,05(mol)
K + H2O -> KOH + 1/2 H2
0,2____________0,1(mol)
=> nH2(tổng)=0,05+0,1=0,15(mol)
=>V(H2,đktc)=0,15 x 22,4= 3,36(l)
Đúng 2
Bình luận (0)
Câu 1: Cho m gam phenol tác dụng với natri dư thấy thoát ra 0.56 lít khí H2 (đktc) Tính khối lượng phenol cần dùng. Câu 2: Chi 4,7 gam phenol tác dụng với nước brom dư, thu được m gam kết tủa Tính m
Câu 1:
\(n_{H_2}=\dfrac{0,56}{22,4}=0,025\left(mol\right)\)
PTHH: \(2C_6H_5OH+2Na\underrightarrow{t^o}2C_6H_5ONa+H_2\)
0,05<--------------------------0,025
=> m = 0,05.94 = 4,7 (g)
Câu 2:
\(n_{C_6H_5OH}=\dfrac{4,7}{94}=0,05\left(mol\right)\)
PTHH: \(C_6H_5OH+3Br_2\rightarrow C_6H_2Br_3OH\downarrow+3HBr\)
0,05--------------->0,05
=> m = 0,05.331 = 16,55 (g)
Đúng 4
Bình luận (0)
1. Cho 2,4 gam magie tác dụng vừa đủ với axit clohidric (HCl). Tính thể tích khí H2 ở đktc. 2. Cho 5,6 gam sắt tác dụng vừa đủ với axit sunfuric loãng (H2SO4 loãng). Tính thể tích khí H2 ở đktc.
1
Mg+HCl->Mgcl2+H2
0,1--------------------0,1
n Mg=0,1 mol
=>VH2=0,1.22,4=2,24l
2
Fe+H2SO4->FeSO4+H2
0,1----------------------------0,1
n Fe=0,1 mol
=>VH2=0,1.22,4=2,24l
Đúng 3
Bình luận (0)
\(1,n_{Mg}=\dfrac{2,4}{24}=0,1\left(mol\right)\)
PTHH: Mg + 2HCl ---> MgCl2 + H2
0,1 0,1
=> VH2 = 0,1.22,4 = 2,24 (l)
\(2,n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
PTHH: Fe + H2SO4 ---> FeSO4 + H2
0,1 0,1
=> VH2 = 0,1.22,4 = 2,24 (l)
Đúng 2
Bình luận (0)
1/ Mg + 2HCl --> MgCl2 + H2
0,1 0,2 0,1 0,1
VH2 = 22,4.0,1 = 2,24lít
2/ Fe + H2SO4 --> FeSO4 + H2
0,1 0,1 0,1 0,1
VH2 = 0,1.22,4 = 2,24lít
Đúng 0
Bình luận (0)