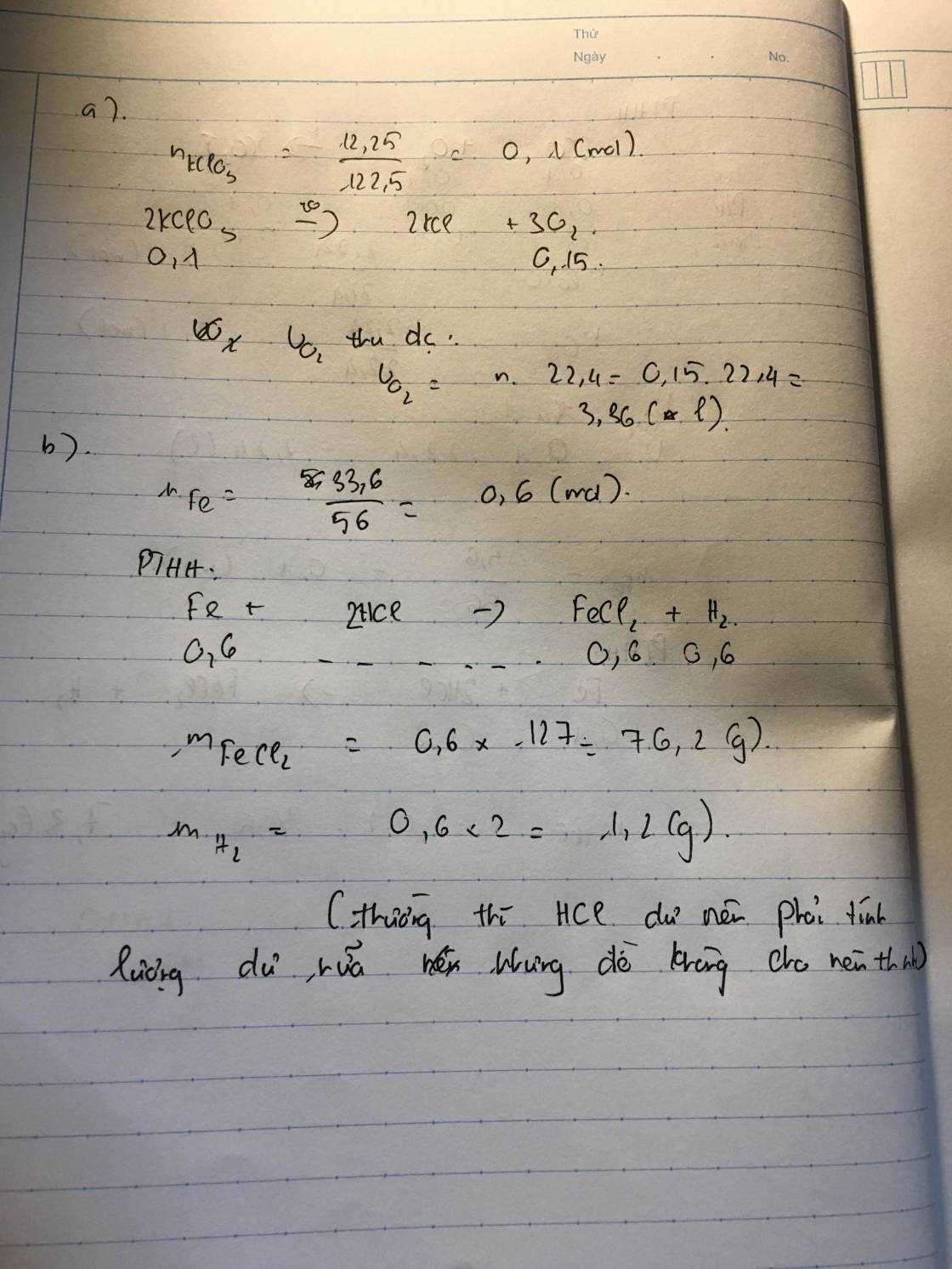Tính thể tích của oxi tạo thành khi nung 65,34 g KCLO3 có 25% tạp chất

Những câu hỏi liên quan
Thực hiện nung a gam KClO3 và b gam KMnO4 để thu khí oxi. Sau khi phản ứng xảy ra hoàn toàn thì thấy khối lượng các chất còn lại sau phản ứng bằng nhau.
a. Tính tỷ lệ \(\dfrac{a}{b}\).
b. Tính tỷ lệ thể tích khí oxi tạo thành của hai phản ứng.
\(n_{KClO_3}=\dfrac{a}{122,5}mol\)
\(n_{KMnO_4}=\dfrac{b}{158}mol\)
\(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
\(\dfrac{a}{122,5}\) \(\dfrac{3a}{245}\)
\(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
\(\dfrac{b}{158}\) \(\dfrac{b}{316}\)
Sau phản ứng các chất còn lại bằng nhau.
\(\Rightarrow m_{KCl}=m_{K_2MnO_4}+m_{MnO_2}\)
Theo hai pt: \(\dfrac{a}{122,5}\cdot74,5=\dfrac{b}{158}\cdot\left(197+87\right)\)
\(\Rightarrow\dfrac{a}{b}=1,48\)
\(\dfrac{V_{O_2\left(KMnO_4\right)}}{V_{O_2\left(KClO_3\right)}}=\dfrac{\dfrac{b}{316}}{\dfrac{3a}{245}}=\dfrac{245b}{948a}=\dfrac{1}{1,48}\cdot\dfrac{245}{948}=0,17\)
Đúng 1
Bình luận (0)
Thực hiện nung a gam KCLO3 và b gam KMnO4 để thu khí oxi. Sau khi phản ứng xảy ra hoàn toàn thì thấy khối lượng các chất còn lại sau phản ứng bằng nhau.
a) tính tỉ lệ a/b
b) tính tỉ lệ thể tích khí oxi tạo thành của 2 phản ứng
2KClO3 → 2KCl + 3O2
a122,5→a122,5.74,5+3a2.22,4�122,5→�122,5.74,5+3�2.22,4
2KMnO4 → K2MnO4 + MnO2 + O2
b158→b2.158.197+b2.158.87+b2.22,4�158→�2.158.197+�2.158.87+�2.22,4
Ta có:
a122,574,5b2.158197+b2.15887�122,574,5�2.158197...
Đọc tiếp
Thực hiện nung a gam KCLO3 và b gam KMnO4 để thu khí oxi. Sau khi phản ứng xảy ra hoàn toàn thì thấy khối lượng các chất còn lại sau phản ứng bằng nhau.
a) tính tỉ lệ a/b
b) tính tỉ lệ thể tích khí oxi tạo thành của 2 phản ứng
2KClO3 → 2KCl + 3O2
2KMnO4 → K2MnO4 + MnO2 + O2
Ta có:
M/n cho e hỏi bài này tại sao lại ra đc nO2 = 3a/2 và b/2 vậy ạ!
a. Nung nóng 12,25(g) KClO3 trong ống nghiệm có mặt MnO2 làm chất xúc tác. Hãy tính thể tích oxi(ĐKTC) thu được. (Cho K 39 ; Cl 35,5 ; O 16)b. Cho 33,6 gam Sắt vào bình chứa dung dịch axit clohđric. Tính khối lượng các sản phẩm tạo thành? (Cho Fe 56 ; H 1 ; Cl 35,5 ; O 16)
Đọc tiếp
a. Nung nóng 12,25(g) KClO3 trong ống nghiệm có mặt MnO2 làm chất xúc tác. Hãy tính thể tích oxi(ĐKTC) thu được. (Cho K = 39 ; Cl = 35,5 ; O= 16)
b. Cho 33,6 gam Sắt vào bình chứa dung dịch axit clohđric. Tính khối lượng các sản phẩm tạo thành? (Cho Fe = 56 ; H = 1 ; Cl = 35,5 ; O= 16)
thực hiện nung a gam KCLO3 và b gam KMnO4 để thu khí oxi. sau khi phản ứng xảy ra hoàn toàn thì thấy khối lượng các chất còn lại sau phản ứng bằng nhau
1. tính tỷ lệ a/b
2. tính tỷ lệ thể tích khí oxi tạo thành của 2 phản ứng
2KClO3 ---> 2KCl + 3O2
a/122,5 a/122,5(74,5)
2KMnO4---------------->K2MnO4 +KMnO2 +o2
b/158 b/316(197) b/316(87)
ta có :
a/122,5 *(74,5)=b/316(197)+ b/316(87)
giải hệ pt
b)tương tự đ/s 4,43
Đúng 0
Bình luận (2)
2KClO3→2KCl+3O22KClO3→2KCl+3O2
2KMnO4→K2MnO4+MnO2+O22KMnO4→K2MnO4+MnO2+O2
Ta có:
nKClO3=a122,5=nKCl→mKCl=a122,5.74,5=74,5a122,5nKClO3=a122,5=nKCl→mKCl=a122,5.74,5=74,5a122,5
nKMnO4=b158→nK2MnO4=nMnO2=12nKMnO4=b316→mK2MnO4+nMnO2=b316.(39.2+55+16.4+55+16.2)=71b79=74,5a122,5→ab=1,47778nKMnO4=b158→nK2MnO4=nMnO2=12nKMnO4=b316→mK2MnO4+nMnO2=b316.(39.2+55+16.4+55+16.2)=71b79=74,5a122,5→ab=1,47778
Ta có:
nO2 trong KClO3=32.nKClO3=32.a122,5;nO2 trong KMnO4=12nKMnO4=b316nO2 trong KClO3=32.nKClO3=32.a122,5;nO2 trong KMnO4=12nKMnO4=b316
Vì % số mol=% thể tích
→VO2 KClO3VO2KMnO4=32.a122,5b316=6,879
Đúng 0
Bình luận (0)
Còn có thể điều chế khí oxi bằng cách nung nóng kali clorat
K
C
l
O
3
(chất rắn màu trắng). Khi đun nóng 24,5g
K
C
l
O
3
, chất rắn còn lại trong ống nghiệm có khối lượng là 13,45g. Tính khối lượng khí oxi thu được, biết hiệu suất của phản ứng phân hủy là 80%.
Đọc tiếp
Còn có thể điều chế khí oxi bằng cách nung nóng kali clorat K C l O 3 (chất rắn màu trắng). Khi đun nóng 24,5g K C l O 3 , chất rắn còn lại trong ống nghiệm có khối lượng là 13,45g. Tính khối lượng khí oxi thu được, biết hiệu suất của phản ứng phân hủy là 80%.
Theo định luật bảo toàn khối lượng, ta có khối lượng khí oxi thu được là:
m O 2 = 24,5 – 13,45 = 11,05(g)
Khối lượng thực tế oxi thu được: m O 2 = (11,05 x 80)/100 = 8,84 (g)
Đúng 0
Bình luận (0)
BÀI 1: đốt cháy hoàn toàn 14 kg than đá có chứa 96%C, 2,56%S còn lại là tạp chất không cháy. Tính thể tích CO2 và SO2 tạo thành?
BÀI 2: tính thể tích khí oxi cần thiết để đốt cháy hoàn toàn khí Etan (C4H8) có trong 1,8m3 khí chứa 2% tạp chất không cháy. Các thể tích đo được ở điều kiện tiêu chuẩn?
B1:
\(n_C=\dfrac{96\%.14.1000}{12}=1120\left(mol\right)\\ n_S=\dfrac{2,56\%.14.1000}{32}=11,2\left(mol\right)\\ C+O_2\rightarrow\left(t^o\right)CO_2\\ S+O_2\rightarrow\left(t^o\right)SO_2\\ n_{SO_2}=n_S=11,2\left(mol\right)\\ n_{CO_2}=n_C=1120\left(mol\right)\\ V_{CO_2\left(đktc\right)}=1120.22,4=25088\left(l\right)\\ n_{SO_2\left(đktc\right)}=11,2.22,4=250,88\left(l\right)\)
Đúng 1
Bình luận (0)
B2:
\(n_{C_2H_6}=\dfrac{1,8.\left(100\%-2\%\right).1000}{22,4}=78,75\left(mol\right)\\ C_2H_6+\dfrac{7}{2}O_2\rightarrow\left(t^o\right)2CO_2+3H_2O\\ n_{O_2\left(đktc\right)}=\dfrac{7}{2}.78,75=275,625\left(mol\right)\\ V_{O_2\left(đktc\right)}=275,625.22,4=6174\left(l\right)=6,174\left(m^3\right)\)
Đúng 1
Bình luận (0)
Những hợp chất nào sau đâycó thể dùng điều chế oxi trong phòng thí nhiệm:KMnO4,KClO3,KnO3,HgO.Tính thể tích khí oxi thu được(đktc)khi nung(khi phân hủy).
a.0,5 mol mỗi chất trên?
b.50g mỗi chất KnO3 hoặc HgO?
a)
2KMnO4 -to-> K2MnO4 + MnO2 + O2
0.5__________________________0.25
VO2 = 0.25*22.4 = 5.6 (l)
2KClO3 -to-> 2KCl + 3O2
0.5_______________0.75
VO2 = 0.75*22.4 = 16.8 (l)
2KNO3 -to-> 2KNO2 + O2
0.5________________0.25
VO2 = 0.25*22.4 = 5.6 (l)
2HgO -to-> 2Hg + O2
0.5____________0.25
VO2 = 0.25*22.4 = 5.6 (l)
b)
nKNO3 = 50/101 (mol)
2KNO3 -to-> 2KNO2 + O2
50/101______________25/101
VO2 = 25/101 * 22.4 = 5.54 (l)
nHgO = 50/217 (mol)
2HgO -to-> 2Hg + O2
50/217 _________25/217
VO2 = 2.58 (l)
Đúng 1
Bình luận (0)
Bài 10: Phương trình nhiệt phân KClO3 như sau: KClO3 - KCl + O2 a/ Tính thể tích khí oxi thu được (đktc) khi nhiệt phân 36,75 gam KClO3. b/ Số phân tử kali clorua tạo thành. c/ Tính khối lượng MgO được tạo thành khi cho lượng khí oxi sinh ra ở trên phản ứng vừa đủ với Mg.
Đọc tiếp
Bài 10: Phương trình nhiệt phân KClO3 như sau:
KClO3 -> KCl + O2
a/ Tính thể tích khí oxi thu được (đktc) khi nhiệt phân 36,75 gam KClO3.
b/ Số phân tử kali clorua tạo thành.
c/ Tính khối lượng MgO được tạo thành khi cho lượng khí oxi sinh ra ở trên phản ứng vừa đủ với Mg.
a) $2KClO_3 \xrightarrow{t^o} 2KCl + 3O_2$
$n_{KClO_3} = \dfrac{36,75}{122,5} = 0,3(mol)$
Theo PTHH : $n_{O_2} = \dfrac{3}{2}n_{KClO_3} = 0,45(mol)$
$\Rightarrow V_{O_2} = 0,45.22,4 = 10,08(lít)$
b) Số phân tử $KCl = 0,45.6.10^{23} = 2,7.10^{23}$ phân tử
c) $2Mg + O_2 \xrightarrow{t^o} 2MgO$
Theo PTHH : $n_{MgO} = 2n_{O_2} = 0,9(mol)$
$m_{MgO} = 0,9.40 = 36(gam)$
Đúng 2
Bình luận (0)
Nung hoàn toàn 12,15 g kali clorat KClO3 ở nhiệt độ cao thấy thoát ra V lít khí oxi thoát ra (đktc). a) Viết PTHH của phản ứng đã xảy ra b) Tính thể tích khí oxi thu được c) Tính khối lượng kẽm cần dùng khi phản ứng với lượng khí oxi được điều chế ở phản ứng trên
a)PTHH:2KClO\(_3\)➞\(^{t^o}\)2KCl+3O\(_2\)
b) n\(_{KClO_3}\)=\(\dfrac{m_{KClO_3}}{M_{KClO_3}}\)=\(\dfrac{12,15}{122,5}\)\(\approx\)0,1(m)
PTHH : 2KClO\(_3\) ➞\(^{t^o}\) 2KCl + 3O\(_2\)
tỉ lệ : 2 2 3
số mol : 0,1 0,1 0,15
V\(_{O_2}\)=n\(_{O_2}\).22,4=0,15.22,4=3,36(l)
c)PTHH : 2Zn + O\(_2\) -> 2ZnO
tỉ lệ : 2 1 2
số mol :0,3 0,15 0,3
m\(_{Zn}\)=n\(_{Zn}\).M\(_{Zn}\)=0,3.65=19,5(g)
Đúng 1
Bình luận (0)