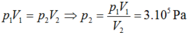Một lượng khí lí tưởng chứa 15dm3 khí ở áp suất Po. Khi pitong nén khí trong xi lanh xuống còn 1/3 thể tích ban đầu thì áp suất tăng thêm 1 lượng 2atm. Tính áp suất Po. Giả sử nén chậm để nhiệt độ không thay đổi.

Những câu hỏi liên quan
1 chất khí lí tưởng ở trạng thái 1 có áp suất P1=2atm. Thể tích V1=30lít, nhiệt độ t1=27*C. Người ta nén đẳng nhiệt thể tích giảm xuống còn 20lít. Tính áp suất chất khí sau khi nén
Tóm tắt:P1=2atm P2=?
V1=30l V2=20l
T1=T2
Áp dụng công thức Bôi lơ Ma ri ôt ta có:
P1.V1=P2.V2⇒P2=P1.V1:V2=2.30:20=3(atm)
Đúng 0
Bình luận (0)
Một xi lanh chứa 150cm3 khí ở áp suất 2.105Pa. Pit tông nén khí trong xi lanh xuống còn 100cm3. Nếu nhiệt độ khí trong xi lanh không đổi thì áp suất của nó lúc này là A. 3.10-5Pa B. 3,5.105Pa C. 3.105Pa D. 3,25.105Pa
Đọc tiếp
Một xi lanh chứa 150cm3 khí ở áp suất 2.105Pa. Pit tông nén khí trong xi lanh xuống còn 100cm3. Nếu nhiệt độ khí trong xi lanh không đổi thì áp suất của nó lúc này là
A. 3.10-5Pa
B. 3,5.105Pa
C. 3.105Pa
D. 3,25.105Pa
Một lượng khí lí tưởng trong xilanh kín được giữ ở nhiệt độ không đổi. Ban đầu lượng khí có thể tích 4m3 và áp suất 3atm. Người ta nén khí tới áp suất 6atm. Tính thể tích khí khi bị nén và vẽ đường biểu diễn quá trình biến đổi trạng thái khí trên trong hệ tọa độ (p,V).
Thể tích của hỗn hợp khí trong xi-lanh là 2 d m 3 , nhiệt độ là 47 ° C và áp suất ban đầu là 1atm. Tính nhiệt độ của hỗn hợp khí trong xi-lanh khi pit-tông nén khí trong xi-lanh làm thể tích giảm đi 10 lần, áp suất tăng đến 15atm.
A. 480K
B. 450K
C. 840K
D. 540K
Đáp án: A
Ta có:
- Trạng thái 1: T 1 = 47 + 273 = 320 K p 1 = 1 a t m V 1 = 2 l
- Trạng thái 2: T 2 = ? p 2 = 15 a t m V 2 = 0,2 l
Áp dụng phương trình trạng thái của khí lý tưởng, ta có:
p 1 V 1 T 1 = p 2 V 2 T 2 ↔ 1.2 320 = 15.0,2 T 2 → T 2 = 480 K
Đúng 0
Bình luận (0)
Đẩy pit-tông của một xilanh đủ chậm để nén lượng khí chứa trong xilanh sao cho thể tích của lượng khí này giảm đi 2 lần ở nhiệt độ không đổi. Khi đó áp suất của khí trong xi lanh
A. giảm đi 2 lần. B. tăng lên 2 lần.
C. tăng thêm 4 lần. D. không thay đổi.
Trong xi lanh của một động cơ đốt trong có 2 lít hỗn hợp khí áp dưới áp suất 1,5 atm và nhiệt độ 270C. Pittông nén xuống làm cho thể tích của hỗn hợp khí chỉ còn bằng 0,3 lít và áp suất tăng lên tới 18 atm. Tính nhiệt độ của hỗn hợp khí nén.
Ta có
TH1 { V 1 = 2 l p 1 = 1 , 5 a t m T 1 = 27 + 273 = 300 K
TH2 { V 2 = 0 , 3 l p 2 = 18 a t m T 2 = ?
Áp dụng
p 1 V 1 T 1 p 2 V 2 T 2 ⇒ T 2 = p 2 V 2 T 1 p 1 V 1 = 18.0 , 3.300 1 , 5.2 T 2 = 540 K
Mà T 2 = 273 + t 2 ⇒ t 2 = 267 0 C
Đúng 0
Bình luận (0)
Trong xi lanh của một động cơ đốt trong có 2 lít hỗn hợp khí áp dưới áp suất 2 atm và nhiệt độ
27
°
C
. Pittông nén xuống làm cho thể tích của hỗn hợp khí chỉ còn bằng 0,2 lít và áp suất tăng lên tới 25 atm. Tính nhiệt độ của hỗn hợp khí nén. A.
77
°
C
B.
102
°
C
C.
217
°
C
D.
277
°
C
Đọc tiếp
Trong xi lanh của một động cơ đốt trong có 2 lít hỗn hợp khí áp dưới áp suất 2 atm và nhiệt độ 27 ° C . Pittông nén xuống làm cho thể tích của hỗn hợp khí chỉ còn bằng 0,2 lít và áp suất tăng lên tới 25 atm. Tính nhiệt độ của hỗn hợp khí nén.
A. 77 ° C
B. 102 ° C
C. 217 ° C
D. 277 ° C
Trong xi lanh của một động cơ đốt trong có 2 lít hỗn hợp khí áp dưới áp suất 1,5 atm và nhiệt độ 27 ° C. Pittông nén xuống làm cho thể tích của hỗn hợp khí chỉ còn bằng 0,3 lít và áp suất tăng lên tới 18 atm. Tính nhiệt độ của hỗn hợp khí nén.
Trong xi lanh của một động cơ đốt trong có 2 lít hỗn hợp khí áp dưới áp suất 2 atm và nhiệt độ
27
°
C. Pittông nén xuống làm cho thể tích của hỗn hợp khí chỉ còn bằng 0,2 lít và áp suất tăng lên tới 25 atm. Tính nhiệt độ của hỗn hợp khí nén A.
77
°
C B.
102
°
C C.
217...
Đọc tiếp
Trong xi lanh của một động cơ đốt trong có 2 lít hỗn hợp khí áp dưới áp suất 2 atm và nhiệt độ 27 ° C. Pittông nén xuống làm cho thể tích của hỗn hợp khí chỉ còn bằng 0,2 lít và áp suất tăng lên tới 25 atm. Tính nhiệt độ của hỗn hợp khí nén
A. 77 ° C
B. 102 ° C
C. 217 ° C
D. 277 ° C