a. Khử hoàn toàn 12 gam Fe2O3 bằng khí hidro. Thể tích khí hidro (đktc) đem dùng là bao nhiêu?
b. Lưu huỳnh (S) cháy trong không khí theo phản ứng: S + O2 --> SO2. Xác định số nguyên tử oxi cần dùng để đốt cháy hết 1,5 mol S.
Giúp mình với :]]]]
Lưu huỳnh cháy trong không khí sinh ra khí sunfurơ, theo phản ứng sau:
S + O 2 − t o → S O 2
Hãy cho biết:
Thể tích khí oxi ở đktc cần dùng để đốt cháy hoàn toàn 2,5 mol nguyên tử lưu huỳnh.
Đốt cháy 8,96 lít khí hidro (đktc). a. Tính thể tích không khí cần dùng, biết thể tích oxi chiếm 20% thể tích không khí (đktc) b. Cũng với lượng hidro đó nếu cho phản ứng hoàn toàn với bột CuO đun nóng thì thu được bao nhiêu gam nước
a)\(n_{H_2}=\dfrac{8,96}{22,4}=0,4mol\)
\(2H_2+O_2\underrightarrow{t^o}2H_2O\)
0,4 0,2 0,4
\(V_{O_2}=0,2\cdot22,4=4,48l\)
\(V_{kk}=5V_{O_2}=5\cdot4,48=22,4l\)
b)\(CuO+H_2\rightarrow Cu+H_2O\)
0,4 0,4
\(m_{H_2O}=0,4\cdot18=7,2g\)
Đốt cháy hoàn toàn 12 gam hỗn hợp bột lưu huỳnh và cacbon trong không khí thu được 28 gam hỗn hợp khí lưu huỳnh đioxit và cacbon đioxit. Thể tích oxi (ở đktc) cần dùng trong phản ứng trên là .
Gọi nC = a (mol); nS = b (mol)
12a + 32b = 12 (1)
PTHH:
C + O2 -> (t°) CO2
a ---> a ---> a
S + O2 -> (t°) SO2
b ---> b ---> b
44a + 64b = 28 (2)
Từ (1)(2) => a = 0,2 (mol); b = 0,3 (mol)
nO2 = 0,2 + 0,3 = 0,5 (mol)
VO2 = 0,5 . 22,4 = 11,2 (l)
: Lưu huỳnh (S) cháy trong không khí sinh ra khí sunfurơ (SO2). Hãy cho biết:
a) Những chất tham gia và tạo thành trong phản ứng trên, chất nào là đơn chất, chất nào là hợp chất ? Vì sao ?
b) Thể tích khí oxi (đktc) cần dùng để đốt cháy hoàn toàn 4,8 g lưu huỳnh
a) Khí sunfurơ nặng hay nhẹ hơn không khí bằng bao nhiêu lần?
Câu 14: Cho 13gam Zn tác dụng với dung dịch H2SO4 thu được ZnSO4 và khí hidro Tính:
a. Thể tích khí H2 thu được ở đktc.
b. Khối lượng H2SO4 phản ứng.
c. Khối lượng ZnSO4 tạo thành.
Câu 15: Cho một hợp chất sắt oxit có tỉ lệ khối lượng giữa sắt và oxi là:
mFe : mO = 7 : 3
a. Hãy xác định công thức phân tử của hợp chất oxit nói trên.
b. Tính số mol của 32g oxit nói trên.
ai chỉ mik vứ
Câu 13:
a) PTHH: \(S+O_2\underrightarrow{t^o}SO_2\)
Chất tham gia: \(S;O_2\)
Chất sp: \(SO_2\)
Đơn chất: \(S;O_2\)
Hợp chất: \(SO_2\)
Vì đơn chất là những chất được tạo từ 1 nguyên tố. Còn hợp chất là chất được tạo từ 2 nguyên tố trở lên.
b) \(n_S=\dfrac{4,8}{32}=0,15\left(mol\right)\)
Từ PTHH ở trên ta có:
1 mol S thì đốt cháy hết 1 mol khí oxi
=> 0,15 mol S thì đốt cháy hết 0,15 mol khí oxi
=> Thể tích của 0,15 khí oxi là:
\(V_{O_2}=0,15.22,4=3,36\left(l\right)\)
Câu 13:
c) \(d_{\dfrac{S}{kk}}=\dfrac{32}{29}>1\)
Lưu huỳnh (S) cháy trong không khí sinh ra khí sunfurơ (SO2). Hãy cho biết:
a) Những chất tham gia và tạo thành trong phản ứng trên, chất nào là đơn chất, chất nào là hợp chất ? Vì sao ?
b) Thể tích khí oxi (đktc) cần dùng để đốt cháy hoàn toàn 4,8 g lưu huỳnh
a) Khí sunfurơ nặng hay nhẹ hơn không khí bằng bao nhiêu lần?
a) S + O2 -> SO2
Chất tham gia phản ứng là S và O2
Chất tạo thành phản ứng là SO2
b) \(n_S=\dfrac{4,8}{32}=0,15\left(mol\right)\)
Thể tích khí oxi (đktc) cần dùng để đốt cháy hoàn toàn 4,8 g lưu huỳnh
\(V_{O_2}=0,15.22,4=3,36\left(l\right)\)
c) dSO2/kk= \(\dfrac{M_{SO_2}}{M_{kk}}=\dfrac{32+16.2}{29}=\dfrac{64}{29}=2.2>1\)
=> Khí sunfurơ nặng hơn không khí 2,2 lần
Lưu huỳnh cháy trong không khí theo phương trình phản ứng
S+O2->SO2
Biết khối lượng lưu huỳnh tham gia phản ứng là 3,2g
a.Tính thể tích khí SO2 sinh ra ở đktc
b.Tính thể tích không khí cần dùng ở đktc
\(n_S=\dfrac{3,2}{32}=0,1mol\)
\(S+O_2\rightarrow\left(t^o\right)SO_2\)
0,1 0,1 0,1 ( mol )
\(V_{SO_2}=0,1.22,4=2,24l\)
\(V_{kk}=V_{O_2}.5=\left(0,1.22,4\right).5=11,2l\)
a. \(n_S=\dfrac{3.2}{32}=0,1\left(mol\right)\)
PTHH : S + O2 ---to---> SO2
0,1 0,1 0,1
\(V_{SO_2}=0,1.22,4=2,24\left(l\right)\)
b. \(V_{O_2}=0,1.22,4=2,24\left(l\right)\\V_{kk}=2,24.5=11,2\left(l\right) \)
Lưu huỳnh (S) cháy trong không khí sinh ra chất khí mùi hắc, gây ho đó là lưu huỳnh đioxit (khí sunfurơ) có công thức hóa học là SO2.
a) Viết phương trình hóa học của lưu huỳnh cháy trong không khí.
b) Biết khối lượng lưu huỳnh tham gia phản ứng là 1,6g. Hãy tìm.
-Thể tích khí sunfurơ sinh ra ở đktc.
-Thể tích không khí cần dùng ở đktc. Biết oxi chiếm 1/5 thể tích không khí.
a) Phương trình hóa học S + O2  SO2
SO2
b) nS = 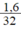 = 0,05 mol.
= 0,05 mol.
Theo phương trình trên, ta có:
nSO2 = nS = nO2 = 0,05 mol.
⇒ VSO2 = 0,05 .22,4 = 1,12 l.
⇒ VO2 = 22,4.0,05 = 1,12 l
Vì khí oxi chiếm 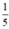 thể tích của không khí nên thể tích không khí cần là
thể tích của không khí nên thể tích không khí cần là
⇒ Vkk = 5VO2 = 5.1,12 = 5,6 l
a) PTHH : \(S+O_2->SO_2\)
b) Ta có : \(n_S\) = \(\dfrac{m_S}{M_S}\) = 0.1 (mol)
Có : \(n_S=n_{O_2}\)
--> \(n_{O_2}\) = 0.1 (mol)
=> \(V_{O_2\left(đktc\right)}\) = \(n_{O_2}\) . 22.4 = 2.24 (L)
\(n_S=\dfrac{3,2}{32}=0,1\left(mol\right)\\ PTHH:S+O_2\underrightarrow{t^o}SO_2\\ \left(mol\right)..0,1\rightarrow0,1..0,1\\ V_{O_2}=0,1.22,4=2,24\left(l\right)\)
Đốt cháy hoàn toàn 3,2 gam lưu huỳnh trong 1,12 lít khí O2 (ĐKTC) chỉ thu được khí duy nhất SO2 (ĐKTC)A, tính thể tích sản phẩm khí sinh ra sau phản ứng (ĐKTC)?B, Tính thể tích không khí cần dung để đốt cháy hết 3,2 gam lưu huỳnh ở trên?Biết Vkk=5VO2
\(n_S=\dfrac{3.2}{32}=0.1\left(mol\right)\)
\(n_{O_2}=\dfrac{1.12}{22.4}=0.05\left(mol\right)\)
\(S+O_2\underrightarrow{t^0}SO_2\)
\(0.05.0.05...0.05\)
\(\Rightarrow Sdư\)
\(V_{SO_2}=0.05\cdot22.4=1.12\left(l\right)\)
\(b.\)
\(S+O_2\underrightarrow{t^0}SO_2\)
\(0.1..0.1\)
\(V_{kk}=5V_{O_2}=5\cdot0.1\cdot22.4=11.2\left(l\right)\)