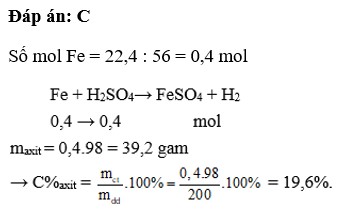Hòa tan 22,4g Fe vừa đủ với dung dịch H2SO4 nồng độ 2M. Thể tích dung dịch H2SO4 là A. 0,3(l). B. 0,2(l). C. 0,13(l). D. 0,6(l).

Những câu hỏi liên quan
Câu 4: Cho 22,4g Fe tác dụng vừa đủ với 200g dung dịch H2SO4 loãng. Nồng độ % của dung dịch axít đã phản ứng là: Câu 5: Hoà tan một lượng sắt vào 400ml dung dịch HCl vừa đủ. Sau phản ứng thu được 3,36 lít khí hidrô (đktc). Nồng độ M của dung dịch HCl là: Câu 6: Cho 9,6 gam kim loại Magie vào 120 gam dung dịch HCl (vừa đủ). Nồng độ phần trăm của dung dịch sau phản ứng là :Help pls !!!!!!!!!!!!
Đọc tiếp
Câu 4: Cho 22,4g Fe tác dụng vừa đủ với 200g dung dịch H2SO4 loãng. Nồng độ % của dung dịch axít đã phản ứng là:
Câu 5: Hoà tan một lượng sắt vào 400ml dung dịch HCl vừa đủ. Sau phản ứng thu được 3,36 lít khí hidrô (đktc). Nồng độ M của dung dịch HCl là:
Câu 6: Cho 9,6 gam kim loại Magie vào 120 gam dung dịch HCl (vừa đủ). Nồng độ phần trăm của dung dịch sau phản ứng là :
Help pls !!!!!!!!!!!!
Câu 4:
Tính khối lượng của H2SO4 có trong dung dịch:
m = n x M x V
Trong đó:
n = 0,4 mol (số mol của H2SO4)
M = 98g/mol (khối lượng mol của H2SO4)
V = 200g (thể tích của dung dịch)
m = 0,4 mol x 98g/mol x 200g / 1000g = 7,84g
% = (khối lượng H2SO4 / khối lượng dung dịch) x 100 % = (7,84g / 200g) x 100 = 3,92% Vậy nồng độ % của dung dịch axít đã phản ứng là 3,92%.
Đúng 1
Bình luận (1)
C6
Mg + 2HCl -> MgCl2 + H2
m = n x M
n = m / M
Trong đó:
m = 9,6g (khối lượng của Mg)
M = 24,31g/mol (khối lượng mol của Mg)
n = 9,6g / 24,31g/mol = 0,395 mol
Mg + 2HCl -> MgCl2 + H2
Tỷ lệ phản ứng của Mg và HCl là 1:2, vì vậy số mol của HCl là 2 x 0,395 mol = 0,79 mol.
Để tính khối lượng của dung dịch sau phản ứng, ta cần biết khối lượng riêng của dung dịch HCl. Với dung dịch HCl có nồng độ 36,5%, khối lượng riêng xấp xỉ là 1,18 g/mL.
V = m / rho
V = 120g / 1,18 g/mL = 101,69 mL (thể tích của dung dịch)
m (HCl) = 0,79 mol x 36,5g/mol = 28,835 g (khối lượng của HCl sau phản ứng)
M (dung dịch sau phản ứng) = m + M(H2O) = 28,835g + 72g = 100,835g
% = (khối lượng chất tan / khối lượng dung dịch) x 100
% = (28,835g / 100,835g) x 100 = 28,62%
Vậy nồng độ phần trăm của dung dịch sau phản ứng là 28,62%.
Đúng 1
Bình luận (1)
`C4:`
`n_[Fe]=[22,4]/56=0,4(mol)`
`Fe+H_2 SO_4 ->FeSO_4 +H_2 \uparrow`
`0,4` `0,4` `(mol)`
`C%_[H_2 SO_4]=[0,4.98]/200 .100=19,6%`
`C5:`
`n_[H_2]=[3,36]/[22,4]=0,15(mol)`
`Fe+2HCl->FeCl_2 +H_2 \uparrow`
`0,3` `0,15` `(mol)`
`C_[M_[HCl]]=[0,3]/[0,4]=0,75(M)`
`C6:`
`n_[Mg]=[9,6]/24=0,4(mol)`
`Mg+2HCl->MgCl_2 +H_2 \uparrow`
`0,4` `0,8` `(mol)`
`C%_[HCl]=[0,8.36,5]/120 .100=24,3%`
Đúng 3
Bình luận (1)
Xem thêm câu trả lời
Hòa tan hoàn toàn 16,8 gam sắt (Fe) bằng 200 gam ( quy đổi thể tích là 250ml ) dung dịch axit sunfuric (H2SO4) vừa đủ thu được dung dịch FeSO4 và V lít khí H2 thoát ra ở (đktc)a) Tìm V , nồng độ mol và nồng độ phần trăm của dung dịch H2SO4 đã dùng ?b) Lượng khí H2 sinh ra ở trên được dẫn qua ống nghiệm đựng 16 (g) CuO đun nóng, phản ứng xảy ra hoàn toàn. Tính khối lượng kim loại thu được?
Đọc tiếp
Hòa tan hoàn toàn 16,8 gam sắt (Fe) bằng 200 gam ( quy đổi thể tích là 250ml ) dung dịch axit sunfuric (H2SO4) vừa đủ thu được dung dịch FeSO4 và V lít khí H2 thoát ra ở (đktc)
a) Tìm V , nồng độ mol và nồng độ phần trăm của dung dịch H2SO4 đã dùng ?
b) Lượng khí H2 sinh ra ở trên được dẫn qua ống nghiệm đựng 16 (g) CuO đun nóng, phản ứng xảy ra hoàn toàn. Tính khối lượng kim loại thu được?
a)
$Fe + H_2SO_4 \to FeSO_4 + H_2$
$n_{H_2SO_4} = n_{H_2} = n_{Fe} = \dfrac{16,8}{56} = 0,3(mol)$
$V = 0,3.22,4 = 6,72(lít)$
$C_{M_{H_2SO_4}} = \dfrac{0,3}{0,25} = 1,2M$
b)
$n_{CuO} = \dfrac{16}{80} = 0,2(mol)$
$CuO + H_2 \xrightarrow{t^o} Cu + H_2O$
$n_{CuO} < n_{H_2}$ nên $H_2$ dư
$n_{Cu} = n_{CuO} = 0,2(mol)$
$m_{Cu} = 0,2.64 = 12,8(gam)$
Đúng 4
Bình luận (0)
\(n_{Fe}=\dfrac{m}{M}=\dfrac{16,8}{56}=0,3\left(mol\right)\\ PT:Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
0,3 0,3 0,3 (mol)
a) V= n. 22,4 = 0,3 . 22,4 = 6,72(l)
\(C\%=\dfrac{m_{H_2SO_4}}{m_{dd}}.100\%=\dfrac{0,3.98}{200}.100\%=11,76\%\)
b) PT: \(H_2+CuO\underrightarrow{t^o}Cu+H_2O\)
0,3 0,3
=> mCu=n.M=0,3.64=19,2(g)
Đúng 0
Bình luận (0)
Cho 22,4g Fe tác dụng vừa đủ với 200g dung dịch H 2 S O 4 loãng. Nồng độ % của dung dịch axít đã phản ứng là
A. 32%
B. 54%
C. 19,6%
D. 18,5%
Hòa tan hoàn toàn 27,84 gam một oxit sắt cần dùng vừa đủ 480ml dung dịch H2SO4, 1M. Xác định công thức phân tử oxit sắt, tính nồng độ mol/l của dd sau phản ứng. Giả sử thể tích dung dịch khônng đáng kể.
FeOx + H2SO4 -> FeSO4 + H2O
Theo phương trình trên, ta thấy tỉ lệ mol giữa FeOx và H2SO4 là 1:1. Điều này có nghĩa là số mol FeOx trong phản ứng bằng số mol H2SO4.
Để tính số mol H2SO4, ta sử dụng công thức:
Số mol = nồng độ x thể tích
Với dung dịch H2SO4 có nồng độ 1M và thể tích 480ml, ta có:
Số mol H2SO4 = 1M x 480ml = 0.48 mol
Do đó, số mol FeOx cũng là 0.48 mol.
Tiếp theo, ta tính khối lượng mol của FeOx:
Khối lượng mol = khối lượng / số mol
Khối lượng mol FeOx = 27.84g / 0.48 mol = 58g/mol (khoảng chừng)
Công thức phân tử của oxit sắt có thể xác định bằng cách so sánh khối lượng mol với khối lượng mol của các nguyên tố trong bảng tuần hoàn. Với khối lượng mol xấp xỉ 58g/mol, ta có thể suy ra rằng công thức phân tử của oxit sắt là Fe2O3.
Để tính nồng độ mol/l của dung dịch sau phản ứng, ta chia số mol H2SO4 cho thể tích dung dịch sau phản ứng (480ml):
Nồng độ mol/l = số mol / thể tích (l)
Nồng độ mol/l của dung dịch sau phản ứng:
= 0.48 mol / 0.48 l = 1M
Vậy, nồng độ mol/l của dung dịch sau phản ứng là 1M.
Đúng 0
Bình luận (0)
Hòa tan a gam Fe vào 200ml dung dịch H2SO4 vừa đủ thu được 3,24 lít khí H2 (ở điều kiện thường) và dung dịch a .a tính nồng độ mol của dung dịch H2SO4 .b,tính nồng độ mol của trong dung dịch a
\(n_{H_2}=\dfrac{3,24}{24}=0,135(mol)\\ Fe+H_2SO_4\to FeSO_4+H_2\\ \Rightarrow n_{H_2SO_4}=n_{FeSO_4}=0,135(mol)\\ \Rightarrow \begin{cases} C_{M_{H_2SO_4}}=\dfrac{0,135}{0,2}=0,675M\\ C_{M_{FeSO_4}}=\dfrac{0,135}{0,2}=0,675M \end{cases}\)
Đúng 1
Bình luận (0)
trộn v1 l dd h2so4 0,3M với v2 l dd naoh0,4M thu đc 0,6l dung dịch A.tính v1,v2 biết 0,3 l dd A hòa tan vừa đủ 0,51 g al2o3
Coi sự pha trộn không thay đổi thể tích và xảy ra hoàn toàn
Hòa tan hoàn toàn 1,08 gam nhôm với dung dịch H2SO4 nồng độ 2M, tạo ra muối và khí H2, thoát ra. Tìm: a/ Thể tích khí H2 (đkc) b/ Thể tích dung dịch H2SO4 cần phản ứng c/ Nồng độ mol dung dịch muối sau phản ứng. Giả sử thể tích dung dịch sau phản ứng không thay đổi
nAl= 0,04(mol)
PTHH: 2 Al + 3 H2SO4 -> Al2(SO4)3 + 3 H2
0,04___________0,06___0,02_____0,06(mol)
a) V(H2, đktc)=0,06.22,4=1,344(l)
b) VddH2SO4= 0,06/2=0,03(l)=30(ml)
c) VddAl2(SO4)3=VddH2SO4=0,03(l)
=>CMddAl2(SO4)3=0,02/0,03=2/3(M)
Đúng 1
Bình luận (4)
\(n_{Al}=\dfrac{1.08}{27}=0.04\left(mol\right)\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(0.04......0.06.............0.02...........0.06\)
\(V_{H_2}=0.06\cdot22.4=1.344\left(l\right)\)
\(V_{dd_{H_2SO_4}}=\dfrac{0.06}{2}=0.03\left(l\right)\)
\(C_{M_{Al_2\left(SO_4\right)_3}}=\dfrac{0.02}{0.03}=\dfrac{2}{3}\left(M\right)\)
Đúng 0
Bình luận (3)
Câu 17(2,0đ) Hòa tan 5,6g Fe trong dung dịch H2SO4 loãng 9,8% vừa đủ thu được dung dịch FeSO4 a.Tính thể tích khí H2 ở ĐKTC thu được sau phản ứng? b.Tính nồng độ phần trăm chất tan có trong dung dịch FeSO4
nFe = 5,6/56 = 0,1 (mol)
Fe + H2SO4 --> FeSO4 + H2
0,1 0,1 0,1 0,1 (mol)
VH2 = 0,1.22,4 = 2,24 (l)
mdd H2SO4 = ( 0,1.98.100% ) / 9,8%= 100 (g)
mH2 = 0,1.2=0,2 (g)
mdd = mFe + mddH2SO4 - mH2
= 5,6 + 100 - 0,2 = 105,4 (g)
mFeSO4 = 0,1.152 = 15,2 (g)
C%ddFeSO4 = ( 15,2.100 ) / 105,4 = 14,42%
Đúng 1
Bình luận (2)
1 cho 7,1 gam al tác dụng vừa đủ vứi 500 ml dung dịch h2so4 loãng tạo ra khí hidoro và nhom sun fatA viết phương trình hóa học xảy raB tính thể tích khí h2 sinh ra ở(đktc)C tinh nồng độ mol/l của dung dịch h2so4 đã cho2 hòa tan 16,12g kẽm bằng dung dịch axit clohdric hcl 10%(vừa đủ)A viết pthh xảy raB tính thể tich khí hidro ở (đktc)C tính khối lượng dung dịch hcl cần dùng
Đọc tiếp
1 cho 7,1 gam al tác dụng vừa đủ vứi 500 ml dung dịch h2so4 loãng tạo ra khí hidoro và nhom sun fat
A viết phương trình hóa học xảy ra
B tính thể tích khí h2 sinh ra ở(đktc)
C tinh nồng độ mol/l của dung dịch h2so4 đã cho
2 hòa tan 16,12g kẽm bằng dung dịch axit clohdric hcl 10%(vừa đủ)
A viết pthh xảy ra
B tính thể tich khí hidro ở (đktc)
C tính khối lượng dung dịch hcl cần dùng
Bài 1:
A . PTHH : 2AI + 3H2SO4 => AI2(SO4)3 + 3H2
B . nAI = 7.1 : 27 = 0.2 (mol)
PT :2AI + 3H2SO4 => AI2(SO4)3 + 3H2
2 mol 3 mol 3 mol
0.2 mol 0.3 mol 0.3 mol
=> VH2 = 22.4 X 0.3 = 6.72 (lít)
3. 500ml = 0.5 lít
Nồng độ mol/l của dd H2SO4 là:
CM H2SO4 = mol/lít =0.3/0.5 = 0.6 MOL/ LÍT
Đúng 0
Bình luận (0)
a)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
b) \(n_{Zn=\frac{16,12}{65}=0,248\left(mol\right)}\)
Theo PTHH : \(n_{H_2}=n_{Zn}=0,248\left(mol\right)\)
\(V_{H_2\left(đktc\right)}=0,248\times22,4=5,5552\left(l\right)\)
c ) Ta có :
Theo PTHH : \(n_{HCl}=2n_{Zn}=0,496\left(mol\right)\)
\(\Rightarrow m_{HCl}=18,104\left(g\right)\)
\(m_{dd}=\frac{18,104\times100}{10}=181,04\left(g\right)\)
Đúng 0
Bình luận (0)