Hòa tan hỗn hợp gồm 27,2 gam Zn và Fe trong 1 mol dung dịch H2SO4.
a, Chứng minh rằng hỗn hợp tan hết.
b, Nếu hòa tan hỗn hợp trên với lượng gấp đôi vào cùng lượng axit trên thì hỗn hợp có tan hết không?
Hòa tan 37,2 gam hỗn hợp A gồm Zn và Fe trong 2 lít dung dịch H2SO4 loãng, có nồng độ 0,5M.
a) Chứng minh rằng hỗn hợp A tan hết?
b) Nếu hòa tan hỗn hợp A có khối lượng gấp đôi ở trên vào lượng dung dịch axit như trên thì hỗn hợp này có tan hết hay không?
a)
\(n_{H_2SO_4}=2.0,5=1\left(mol\right)\)
Giả sử hỗn hợp chỉ có Fe (Do MFe < MZn)
=> \(n_{Fe}=\dfrac{37,2}{56}=\dfrac{93}{140}\left(mol\right)\)
PTHH: Fe + H2SO4 --> FeSO4 + H2
\(\dfrac{93}{140}\)--> \(\dfrac{93}{140}\)
=> \(n_{H_2SO_4\left(pư\right)}=\dfrac{93}{140}< 1\)
=> A tan hết
b)
Giả sử hỗn hợp chỉ có Zn (Do MFe < MZn)
\(n_{Zn}=\dfrac{37,2.2}{65}=\dfrac{372}{325}\left(mol\right)\)
PTHH: Zn + H2SO4 --> ZnSO4 + H2
\(\dfrac{372}{325}\)--> \(\dfrac{372}{325}\)
=> \(n_{H_2SO_4\left(pư\right)}=\dfrac{372}{325}>1\)
=> A không tan hết
a)
\(n_{H_2SO_4}=2.0,5=1\left(mol\right)\)
Giả sử hỗn hợp chỉ có Fe (Do MFe < MZn)
=> \(n_{Fe}=\dfrac{37,2}{56}=\dfrac{93}{140}\left(mol\right)\)
PTHH: Fe + H2SO4 --> FeSO4 + H2
\(\dfrac{93}{140}\)--> \(\dfrac{93}{140}\)
=> \(n_{H_2SO_4\left(pư\right)}=\dfrac{93}{140}< 1\)
=> A tan hết
b)
Giả sử hỗn hợp chỉ có Fe (Do MFe < MZn)
\(n_{H_2SO_4\left(pư\right)}=2.\dfrac{93}{140}=\dfrac{93}{70}>1\)
=> A không tan hết
Hoà tan hỗn hợp X gồm 37,2 gam Zn và Fe trong 1 mol H2SO4
a. Chứng minh hỗn hợp X tan hết.
b. Nếu hoà tan với lượng gấp đôi hỗn hợp X cùng lượng axit trên thì hỗn hợp có tan hết không?
A, a.tan hết, b.không tan hết
B, a.tan hết, b. tan hết
C, a. không tan hết, b.không tan hết
D, a.không tan hết, b. tan hết
a. Có các phản ứng hóa học xảy ra:
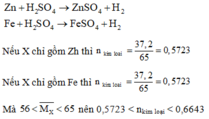
Ta có: n H 2 S O 4 phản ứng = nkim loại < 0,6643
Mà: n H 2 S O 4 ban đầu = 1 > 0,6643 nên sau phản ứng kim loại tan hết, axit còn dư.
b. Khi sử dụng lượng X gấp đôi thì 0,5723.2 < nkim loại < 0,6643.2
Hay 1,1446 < nkim loại < 1,3286
Mà nếu các kim loại bị hòa tan hết thì n H 2 S O 4 phản ứng = nkim loại > 1,1446
Do n H 2 S O 4 thực tế = 1 < 1,1446 nên sau phản ứng kim loại chưa tan hết.
Đán án A
Một hỗn hợp A gồm Zn và Fe có khối lượng là 37,2 gam. Hòa tan hỗn hợp trong dung dịch có chứa 98 gam H2SO4.
a) Hỗn hợp A có tan hết hay không? Giải thích.
b) Nếu dùng một lượng hỗn hợp Zn và Fe gấp đôi hỗn hợp A, lượng H2SO4 vẫn như cũ thì hỗn hợp A có tan hết không?
c) Tính khỗi lượng mỗi kim loại trong hốn hợp A biết rằng lượng khí H2 sinh ra trong phản ứng tác dụng vừa đủ với 48 gam CuO.
Hòa tan hết a gam hỗn hợp X gồm Fe và một oxit sắt trong b gam dung dịch H2SO4 9,8% (lượng vừa đủ), sau phản ứng thu được dung dịch chứa 51,76 gam hỗn hợp hai muối khan. Mặt khác nếu hòa tan hết a gam X bằng dung dịch H2SO4 đặc nóng thì thu được duy nhất 58 gam muối Fe (III). Giá trị của b l
A. 370
B. 220
C. 500
D. 420
Hòa tan hết a gam hỗn hợp X gồm Fe và một oxit sắt trong b gam dung dịch H2SO4 9,8% (lượng vừa đủ), sau phản ứng thu được dung dịch chứa 51,76 gam hỗn hợp hai muối khan. Mặt khác nếu hòa tan hết a gam X bằng dung dịch H2SO4 đặc nóng thì thu được duy nhất 58 gam muối Fe (III). Giá trị của b là:
A. 370
B. 220
C. 500
D. 420
Đáp án A
nFe = 2. 58/400 = 0,29 mol
nFeSO4 = x , nFe2(SO4)3 = y
⇒mdd = 152 x + 400y = 51,76
nFe = nFeSO4 +2.nFe2(SO4)3 = x+ 2y = 0,29
⇒x= 0,13 mol , y= 0,08 mol
BT S: nH2SO4 = nFeSO4 + 3Fe2(SO4)3 = 0,13 + 3.0,08 = 0,37
⇒b = 0,37.98/9,8% = 370g
Hòa tan hết a gam hỗn hợp X gồm Fe và một oxit sắt trong b gam dung dịch H2SO4 9,8% (lượng vừa đủ), sau phản ứng thu được dung dịch chứa 51,76 gam hỗn hợp hai muối khan. Mặt khác nếu hòa tan hết a gam X bằng dung dịch H2SO4 đặc nóng thì thu được duy nhất 58 gam muối Fe (III). Giá trị của b là:
A. 370
B. 220
C. 500
D. 420
Đáp án A
nFe2(SO4)3 = 58/400 = 0,145 mol
nFeSO4 = a ; nFe2(SO4)3 =b
⇒152a + 400b = 51,76
BT Fe: a + 2b = 0,145 . 2 = 0,29 ⇒ a= 0,13 mol; b= 0,08 mol
BT S: nH2SO4 = n FeSO4 + 3nFe2( SO4)3 = 0,13 + 3. 0,08 = 0,37
⇒b= 0,37 .98 /0,098 =370g
Hòa tan hết 14,9 gam hỗn hợp gồm Fe, Zn trong dung dịch chứa 0,09 mol HNO3 và 0,51 mol HCl thu được 0,17 mol hỗn hợp khí Y gồm H2 và NO và dung dịch Z chỉ chứa m gam muối trung hòa (không chứa muối Fe3+). Phần trăm khối lượng của Fe trong hỗn hợp ban đầu gần nhất là:
A. 46%
B. 49%
C. 51%
D. 56%
Hỗn hợp X gồm Zn , Mg và Fe. Hòa tan hết 23,40 gam hỗn hợp X vào dung dịch HCl thu được 11,20 lít khí (đktc). Để tác dụng với vừa hết 23,40 gam hỗn hợp X cần 12,32 lít khí Clo (đktc). Khối lượng của Fe trong hỗn hợp là :
A. 8,4 g.
B. 11,2 g
C. 2,8 g
D. 5,6 g.
+ HCl và Cl2 đều đóng vai trò chất oxi hóa, mấu chốt của bài toán ta cần nhận ra được: Zn, Mg có hóa trị không đổi; Fe có nhiều hóa trị, cụ thể khi tác dụng với dung dịch thu được muối sắt (II), còn khi tác dụng với Cl2 thu được muối sắt (III).
+ Sử dụng công thức tính nhanh số mol Fe trong X:
![]()
![]()
![]()
Đáp án D
Hỗn hợp X gồm Zn , Mg và Fe. Hòa tan hết 23,40 gam hỗn hợp X vào dung dịch HCl thu được 11,20 lít khí (đktc). Để tác dụng với vừa hết 23,40 gam hỗn hợp X cần 12,32 lít khí Clo (đktc). Khối lượng của Fe trong hỗn hợp là
A. 8,4 g
B. 11,2 g
C. 2,8 g
D. 5,6 g
Đáp án D
Bảo toàn e:
+) X + HCl: 2nZn + 2nMg + 2nFe = 2nH2 = 1,0 mol
+) X + Cl2: 2nZn + 2nMg + 3nFe = 2nCl2 = 1,1 mol( khi phản ứng với Cl2, Fe thể hiện hóa trị 3)
⇒ nFe = 1,1 - 1,0 = 0,1 mol ⇒ mFe = 5,6 g