hòa tan hoàn toàn 3,9g hỗn hợp Mg và Al cần dùng 200ml dung dịch hcl 2M. khối lượng của Mg

Những câu hỏi liên quan
Để hòa tan hoàn toàn 12 gam hỗn hợp CuO và MgO cần dùng 200ml dung dịch HCl 2M. Tính thành phần % theo khối lượng của CuO trong hỗn hợp (Cu = 64, O = 16, Mg = 24).
Gọi x, y lần lượt là số mol của CuO, MgO ta có:
80x + 40y = 12 và 2(x + y) = 0,4
Giải ra x = 0,1 mol; y = 0,1 mol.
Vậy khối lượng của CuO = 8 gam.
Phần trăm khối lượng của CuO là
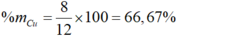
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn 15,4 gam hỗn hợp mg và zn bằng dung dịch hcl 2M thì thu được 6,72 (đktc)
a) Tính khối lượng Mg và Zn trong hỗn hợp
b) Tính thể tích dung dịch HCL 1M cần dùng
Mg+2HCl->MgCl2+H2
x------------------------x
Zn+2HCl->ZnCl2+H2
y-----------------------y
=>Ta có :\(\left\{{}\begin{matrix}24x+65y=15,4\\x+y=0,3\end{matrix}\right.\)
=>\(\left\{{}\begin{matrix}x=0,1mol\\y=0,2mol\end{matrix}\right.\)
=>m Mg=0,1.24=2,4g
=>m Zn=0,2.65=13g
b)VHCl=\(\dfrac{0,1.2+0,2.2}{2}\)=0,3l=300ml
Đúng 2
Bình luận (0)
Câu 1: Có bao nhiêu loại oxit? Mỗi loại lấy một chất làm ví dụ.Câu 2: Để hòa tan hoàn toàn 12 gam hỗn hợp CuO và MgO cần dùng 200ml dung dịch HCl 2M. Tính thành phần % theo khối lượng của CuO trong hỗn hợp (Cu 64, O 16, Mg 24).Câu 3: Cho 17,2 gam Ba(OH)2 vào 250 gam dung dịch H2SO4 loãng, dung dịch sau phản ứng làm quỳ tím hóa đỏ. Tìm khối lượng dung dịch sau phản ứng (Ba 137, S 32, O 16, H 1).Câu 4: Viết phương trình phản ứng phân hủy các chất: Cu(OH)2, Fe(OH)3, H2SO3.Câu 5: Hãy pha chế...
Đọc tiếp
Câu 1: Có bao nhiêu loại oxit? Mỗi loại lấy một chất làm ví dụ.
Câu 2: Để hòa tan hoàn toàn 12 gam hỗn hợp CuO và MgO cần dùng 200ml dung dịch HCl 2M. Tính thành phần % theo khối lượng của CuO trong hỗn hợp (Cu = 64, O = 16, Mg = 24).
Câu 3: Cho 17,2 gam Ba(OH)2 vào 250 gam dung dịch H2SO4 loãng, dung dịch sau phản ứng làm quỳ tím hóa đỏ. Tìm khối lượng dung dịch sau phản ứng (Ba = 137, S = 32, O = 16, H = 1).
Câu 4: Viết phương trình phản ứng phân hủy các chất: Cu(OH)2, Fe(OH)3, H2SO3.
Câu 5: Hãy pha chế dung dịch nước vôi trong từ CaO.
Bài 6: Nhận biết được 3 dung dịch KOH, HCl, H2SO4 (loãng) bằng một thuốc thử .
Hòa tan hoàn toàn 7,8g hỗn hợp Al, Mg vào binhg đựng dung dịch HCl khối lượng dung dịch chỉ tăng 7g. Khối lượng của nhôm là (H=1, Mg=24, Al=27)
A. 5,8 g
B. 2,4 g
C. 2,7 g
D. 5,4 g
Đáp án D
Mg + 2HCl → MgCl2 + H2↑
2Al + 6HCl → 2AlCl3 + 3H2↑
Khối lượng H2↑ = 7,8 – 7 = 0,8 gam. Suy ra nH2 = 0,4 mol
Gọi số mol của Mg và Al lần lượt là x và y,
ta có: 24x + 27y = 7,8 (I)
nH2 = x + 1,5y = 0,4 (II)
Giải phương trình (I) và (II) ta có: x = 0,1 mol và y = 0,2 mol
Khối lượng của nhôm: 0,2 x 27 = 5,4 gam
Đúng 0
Bình luận (0)
Hòa tan 12,6 gam hỗn hợp bột Al và Mg vào dung dịch HCl thu được 13,44 lít H2 (dktc) a.Viết các phương trình phản ứng hóa học xảy ra. b. Tính % khối lượng của Al và Mg có trong hỗn hợp. c. ’Tính khối lượng HCl cần dùng.
ta có phương trình:
2Al+6HCl=>2AlCl3+3H2
a 1.5a
Mg+2HCl=>MgCl2+H2
b b
ta có vH2=13.44(lít)=>nH2=13.4422.4=0.6(mol)
gọi a là số mol của Al,b là số mol của Mg
=>1.5a+b=0.6(mol)(1)
27a+24b=12.6(g)(2)
từ (1)(2)=>a=0.2(mol),b=0.3(mol)
=>%Al=0.2∗2712.6*100=42.86%
=>%Mg=100-42.86=57.14%
Đúng 1
Bình luận (1)
Hoà tan hoàn toàn 7,8 g hỗn hợp Al,Mg vào dung dịch HCl dư.Sau phản ứng khối lượng dung dịch tăng 7g.Tính khối lượng của Mg,Al trong hỗn hợp
Ta có: \(m_{tăng}=m_{KL}-m_{H_2}\) \(\Rightarrow m_{H_2}=0,8\left(g\right)\) \(\Rightarrow n_{H_2}=\dfrac{0,8}{2}=0,4\left(mol\right)\)
PTHH: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
a_____________________\(\dfrac{3}{2}\)a (mol)
\(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)
b____________________b (mol)
Ta lập HPT: \(\left\{{}\begin{matrix}27a+24b=7,8\\\dfrac{3}{2}a+b=0,4\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Mg}=0,1\cdot24=2,4\left(g\right)\\m_{Al}=5,4\left(g\right)\end{matrix}\right.\)
Đúng 3
Bình luận (1)
Hòa tan hoàn toàn 5,1 gam hỗn hợp gồm Mg và Al vào dung dịch HCl 7,3% (D=1,2g/ml) thì thu được 5,6l lít khí B (điều kiện tiêu chuẩn)
a) tính thành phần phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu
b) tính thể tích dung dịch HCl cần dùng
a) Đặt \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Al}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow24a+27b=5,1\) (1)
Ta có: \(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Bảo toàn electron: \(2a+3b=0,5\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,1\cdot24}{5,1}\cdot100\%\approx47,06\%\\\%m_{Al}=52,94\%\end{matrix}\right.\)
b) Bảo toàn nguyên tố: \(n_{HCl}=2n_{H_2}=0,5\left(mol\right)\)
\(\Rightarrow m_{ddHCl}=\dfrac{0,5\cdot36,5}{7,3\%}=250\left(g\right)\)
\(\Rightarrow V_{HCl}=\dfrac{250}{1,2}\approx208,33\left(ml\right)\)
Đúng 1
Bình luận (0)
Hòa tan hoàn toàn 44,1 hỗn hợp 3 kim loại Zn, Al, Mg trong dung dịch HCl. Sau phản ứng thu được 31,36 lít khí H2 ( đktc ). Tính % khối lượng mỗi kim loại có trong hỗn hợp trước phản ứng? Biết khối lượng HCl đùng để hòa tan Zn = khối lượng HCl dùng để hòa tan Al
\(n_{Zn} = a(mol) ; n_{Al} = b(mol) ; n_{Mg} = c(mol)\\ \Rightarrow 65a + 27b + 24c = 44,1(1)\\ Zn + 2HCl \to ZnCl_2 + H_2\\ 2Al + 6HCl \to 2AlCl_3 + 3 H_2\\ Mg + 2HCl \to MgCl_2 + H_2\\ n_{H_2} = a + 1,5b + c = \dfrac{31,36}{22,4} = 1,4(2)\\ Mà : 2a = 3b(3)\\ (1)(2)(3) \Rightarrow a = 0,3 ; b = 0,2 ; c = 0,8\\ \%m_{Zn} = \dfrac{0,3.65}{44,1}.100\% = 44,22\%\\ \%m_{Al} = \dfrac{0,2.27}{44,1}.100\% = 12,24\%\)
\(\%m_{Mg} = 100\% -44,22\% -12,24\% = 43,54\%\)
Đúng 2
Bình luận (0)
Hòa tan hoàn toàn 10,2g hỗn hợp X gồm Mg và Al vào dung dịch HCl. Trong hỗn hợp X, Mg chiếm 47,06% về khối lượng.
a) Viết các phản ứng xảy ra.
b) Tính thể tích của khí thu được.
c) Tính khối lượng muối sau phản ứng
Mình đang cần gấp ạ!
a. PTHH: Mg + 2HCl → MgCl2 + H2
x -> x x
2Al + 6HCl → 2AlCl3 + 3H2
y -> y 3y/2
b. Mg chiếm 47.06% về khối lượng trong hỗn hợp X => Khối lượng của Mg trong hỗn hợp X là: 10,2 x 47,06% = 4,8 (g)
=> Khối lượng của Al trong hỗn hợp X là: 10,2 - 4,8 = 5,4 (g)
=> Số mol Mg là: 4,8/24 = 0,2 (mol)
Số mol Al là: 5,4/27 = 0,2 (mol)
=> Tổng số mol khí thu được từ 2 PTHH trên là: 0,2 + 3/2 x 0,2 = 0,5 (mol)
=> Thể tích của khí thu được (ĐKTC) là: 0,5 x 22,4 = 11,2 (l)
c. Tổng khối lượng muối thu được sau phản ứng là:
0,2 x (24 + 35,5 x 2) + 0,2 x (27 + 35,5 x 3) = 45,7 (g)
Đúng 3
Bình luận (0)




















