Tính số phân tử, khối lượng , thể tích của:
0,3 mol kim loại Cu ,D=8,9 cm3
Nếu thừa nhận rằng nguyên tử Ca, Cu đều có dạng hình cầu, sắp xếp đặc khít bên nhau thì thể tích chiếm bởi các nguyên tử kim loại chỉ bằng 74% so với toàn thể khối tinh thể. Hãy tính thể tích nguyên tử Ca, Cu biết khối lượng riêng ở đktc của chúng đều ở thể rắn tương ứng là 1,55g/cm3, 8,9g/cm3 và khối lượng nguyên tử Ca là 40,08 đvc, của Cu 63,546đvc.
bài 2
Biết tỉ khối của kim loại bạch kim Pt bằng 21,45. Khối lượng nguyên tử bằng 195 đvc. Tỉ khối của nguyên tử vàng bằng 19,5 và khối lượng nguyên tử bằng 197. Hãy so sánh số nguyên tử kim loại chứa trong 1 cm3 mỗi kim loại trên.
Ai biết hóa giúp mình với
bài 2 : Để so sánh số nguyên tử thì mình có thể thông qua số mol vì
N = n.N0 (N0 là số Avogadro)
n = m/M = DV/M
n(Pt) = 21.45 x 1/195
n(Au) = 19.5 x 1/197
Bạn tự bấm máy tính để ra kq nhe :D
bài 1 : thể tích 1 mol Ca
V=40.08∗0.741.55=6.02∗1023∗4/3∗pi∗R3V=40.08∗0.741.55=6.02∗1023∗4/3∗pi∗R3
trong đó V=m/d=4/3∗pi∗R3V=m/d=4/3∗pi∗R3
còn 6.02∗10236.02∗1023 là số lượng nguyên tử của 1 mol
máy tỉnh bỏ túi solve hoặc giải pt bằng tay là ra R=1.96∗10−8R=1.96∗10−8
với Cu cậu làm tương tự là ra
Chiều dày của một lớp niken phủ lên một tấm kim loại là h = 0,05 mm sau khi điện phân trong 30 phút. Diện tích mặt phủ của tấm kim loại là 30 c m 2 . Xác định cường độ dòng điện chạy qua bình điện phân. Biết niken có khối lượng mol nguyên tử là A = 58 g/mol, hoá trị n = 2 và có khối lượng riêng là ρ = 8 , 9 g / c m 3 .
Ta có m = ρ V = ρ S h = 1 , 335 g ; m = 1 F . A n . I t ⇒ I = m F n A t = 2 , 47 A .
1 hợp kim cảu Cu và Zn có khối lượng là 124g có thể tích là 15 cm3 .tính khối lượng mỗi kim loại trong hợp kim biết 49g Cu thể tích 15 cm3 7g Zn có thể tích 1 cm3
Khối lượng riêng của kim loại canxi là 1 , 55 g / c m 3 . Khối lượng mol của nguyên tử canxi là 40 g/mol. Trong tinh thể canxi, các nguyên tử là những hình cầu chiếm 74% thể tích tinh thể, phần còn lại là khe rỗng. Bán kính nguyên tử canxi tính theo lí thuyết là
A. 0,196 nm.
B. 0,185 nm.
C. 0,168 nm.
D. 0,155nm.
Chọn A
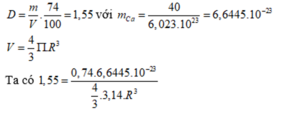
→ R = 1,96.10-8 (cm) = 0,196nm.
Bài 3: Tính:
a. Số mol của: 5,6g Fe ; 9,92l khí CO2 ; 5,85g NaCl.
b. Khối lượng của: 0,05 mol Cu ; 1 mol Al2O3.
c. Thể tích của các khí sau (ở đkc: 250C , 1atm): 0,3 mol khí O2 ; 0,25 mol khí N2.
d. Số nguyên tử hay số phân tử của 3 mol nguyên tử silver; 4g NaOH; 7,2g nguyên tử magnesium;
3,42g phân tử Al2(SO4)3; 1116ml phân tử khí oxygen.
Bài 4. Tính thể tích (đo ở đktc) của: a) 0,5 mol SO2 b) 3,2 g CH4 c) 0,9.1023 phân tử khí N2
Bài 5. Tính khối lượng của: a) 0,1 mol Al b) 0,3 mol Cu(NO3)2 ; c) 1,2.1023 phân tử Na2CO3 d) 8,96 lít CO2 (đktc) ; e) Mỗi nguyên tố có trong 0,5 mol K2CO3
cứu mình cần gấp
4.
a) \(V_{SO_2}=0.5\cdot22.4=11.2\left(l\right)\)
b) \(V_{CH_4}=\dfrac{3.2}{16}\cdot22.4=4.48\left(l\right)\)
c) \(V_{N_2}=\dfrac{0.9\cdot10^{23}}{6\cdot10^{23}}\cdot22.4=3.36\left(l\right)\)
5.
a) \(m_{Al}=0.1\cdot27=2.7\left(g\right)\)
b) \(m_{Cu\left(NO_3\right)_2}=0.3\cdot188=56.4\left(g\right)\)
c) \(m_{Na_2CO_3}=\dfrac{1.2\cdot10^{23}}{6\cdot10^{23}}\cdot106=21.2\left(g\right)\)
d) \(m_{CO_2}=\dfrac{8.96}{22.4}\cdot44=17.6\left(g\right)\)
e) \(m_K=0.5\cdot2\cdot39=39\left(g\right)\\ m_C=0.5\cdot12=6\left(g\right)\\ m_O=0.5\cdot3\cdot16=24\left(g\right)\)
Trong tinh thể, nguyên tử crom chiếm 68% về thể tích. Khối lượng riêng của kim loại crom là 7,19 g/cm3. Bán kính nguyên tử tương đối của nguyên tử Cr là (biết khối lượng mol của Cr = 52)
A. 1,17. 10-8 cm.
B. 1,25.10-8 cm.
C. 1,12. 10-8 cm.
D. 1,54. 10-8 cm.
Hãy tính thể tích 1 mol của mỗi kim loại (nhiệt độ, áp suất trong phòng thí nghiệm), biết khối lượng riêng (g/cm3) tương ứng là : Da/ = 2,7 ; DK = 0,86 ; DCu = 8,94.
Thể tích mol là thể tích chiếm bởi M gam kim loại đó. Áp dụng công thức:
V = , với m = M gam.
VAl = =
= 10cm3. ; Vk =
=
= 45,35 cm3.
VCu = =
= 7,16 cm3.
đầu tiên bạn tìm m của từng kim loại bằng cách lấy 1 mol nhân với khối lượng mol bằng CT:m=n.M
sau đó tính thể tích theo CT:V=m/D
ok nha
a. Tính số mol của : 14g Fe, 25g CaCO3, 4gNaOH, 1,5.1023phân tử
b. Tính khối lượng của: 0,25 mol ZnSO4,0,2 mol AICI3, 0,3 mol Cu; 0,35 mol Fe2(SO4)3
c. Tính thể tích của các chất khí ở đktc: 0,2 mol CO2; 0,15 mol CI2; 0,3 mol SO2
a) \(n_{Fe}=\dfrac{14}{56}=0,25\left(mol\right)\)
\(n_{CaCO_3}=\dfrac{25}{100}=0,25\left(mol\right)\)
\(n_{NaOH}=\dfrac{4}{40}=0,1\left(mol\right)\)
\(n_{...}=\dfrac{1,5.10^{23}}{6.10^{23}}=0,25\left(mol\right)\)
b)
\(m_{ZnSO_4}=0,25.161=40,25\left(g\right)\)
\(m_{AlCl_3}=0,2.133,5=26,7\left(g\right)\)
\(m_{Cu}=0,3.64=19,2\left(g\right)\)
\(m_{Fe_2\left(SO_4\right)_3}=0,35.400=140\left(g\right)\)
d) \(V_{CO_2}=0,2.22,4=4,48\left(l\right)\)
\(V_{Cl_2}=0,15.22,4=3,36\left(l\right)\)
\(V_{SO_2}=0,3.22,4=6,72\left(l\right)\)