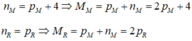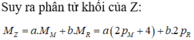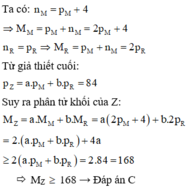Hạt nhân của nguyên tử nguyên tố A có khối lượng là 38,41.10-27kg. Số hạt trong nhân nhiều hơn trong vỏ là 12. Hãy cho biết số lượng các loại hạt cơ bản tạo nên A. Biết mỗi hạt proton và notron có khối lượng 1,67.10-27kg

Những câu hỏi liên quan
Nguyên tử nguyên tố X có số proton trong hạt nhân (điện tích hạt nhân) là 13+. Trong nguyên tử nguyên tố X, số hạt mang điện nhiều hơn số hạt không mang điện là 12 hạt. a) Hãy cho biết tổng số proton và nơtron (số khối) của nguyên tử nguyên tố X. b) Biết proton và nơtron có cùng khối lượng và bằng 1đvC. Tính khối lượng nguyên tử của X. c) Vẽ sơ đồ đơn giản của nguyên tử nguyên tố X. d) X là nguyên tố nào? Kí hiệu hoá học của X.
Đọc tiếp
Nguyên tử nguyên tố X có số proton trong hạt nhân (điện tích hạt nhân) là 13+. Trong nguyên tử nguyên tố X, số hạt mang điện nhiều hơn số hạt không mang điện là 12 hạt. a) Hãy cho biết tổng số proton và nơtron (số khối) của nguyên tử nguyên tố X. b) Biết proton và nơtron có cùng khối lượng và bằng 1đvC. Tính khối lượng nguyên tử của X. c) Vẽ sơ đồ đơn giản của nguyên tử nguyên tố X. d) X là nguyên tố nào? Kí hiệu hoá học của X.
Cho các phát biểu sau: (1). Tất cả các hạt nhân nguyên tử đều được cấu tạo từ các hạt proton và notron. (2). Khối lượng nguyên tử tập trung phần lớn ở lớp vỏ. (3). Trong nguyên tử số electron bằng số proton. (4). Trong hạt nhân nguyên tử hạt mang điện là proton và electron. (5). Trong nguyên tử, hạt electron có khối lượng không đáng kể so với các hạt còn lại. Số phát biểu đúng là A. 1 B. 2 C. 3 D. 4
Đọc tiếp
Cho các phát biểu sau:
(1). Tất cả các hạt nhân nguyên tử đều được cấu tạo từ các hạt proton và notron.
(2). Khối lượng nguyên tử tập trung phần lớn ở lớp vỏ.
(3). Trong nguyên tử số electron bằng số proton.
(4). Trong hạt nhân nguyên tử hạt mang điện là proton và electron.
(5). Trong nguyên tử, hạt electron có khối lượng không đáng kể so với các hạt còn lại.
Số phát biểu đúng là
A. 1
B. 2
C. 3
D. 4
Đáp án B
(1) sai vì như Hiđro không có notron.
(2) sai vì khối lượng nguyên tử tập trung ở phần hạt nhân nguyên tử.
(3) đúng.
(4) sai vì hạt nhân không có electron.
(5) đúng.! ⇒ có 2 phát biểu đúng.
Đúng 1
Bình luận (0)
Tổng số hạt cơ bản (là hạt proton, notron và electron) trong nguyên tử I là 32, trong hạt nhân nguyên tử I, số hạt không mang điện nhiều hơn số hạt mang điện là 1.
a) Tìm số hạt mỗi loại?
b) Vẽ cấu tạo nguyên tử I. Cho nhận xét?
theo đề bài, ta có 2p+n=32 (p=e)
và p-n=1->n=p-1
do đó ta được 2p+p-1=32
<=>3p=33
<=>p=11->e=11
=>n =11-1=`10
Đúng 2
Bình luận (0)
Nguyên tử nguyên tố x có tổng số hạt proton notron electron là 34 hạt trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 10 hạt
a, xác định nguyên tố x
b, tính khối lượng bằng gam của một nguyên tử x biết khối lượng của một nguyên tử C là 1,9926×10^_23 gam và nguyên tử khối của Cacbon bằng 12 dvc
Xem chi tiết
a, Gọi số proton, electron và notron của X lần lượt là p;e;n
Theo gt ta có:
\(\left\{{}\begin{matrix}2p+n=34\\2p-n=10\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}p=11\\n=12\end{matrix}\right.\)
Vậy X là Na
b, Ta có: $m_{Na}=23.1,9926.10^{-23}:12=3,819.10^{-23}$
Đúng 1
Bình luận (0)
Nguyên tử X có số hạt p, n, e là 34 → p + n + e = 34 → 2p + n = 34 (1)
Trong đó, số hạt mang điện nhiều hơn số hạt không mang điện là 10 → p + e – n = 10 → 2p – n = 10 (2)
Từ (1) và (2) → p = 11, n = 12
Số khối A = p + n = 11 + 12 = 23
Đúng 0
Bình luận (0)
Hợp chất Z tạo bởi 2 nguyên tố M, R có công thức MaRb trong đó R chiếm 6,667% khối lượng. Trong hạt nhân nguyên tử M có số nơtron nhiều hơn số proton 4 hạt; còn trong hạt nhân R có số nơtron bằng số proton; tổng số hạt proton trong Z là 84 và a+b4. Khối lượng phân tử Z là A. 67 B. 161 C. 180 D. 92
Đọc tiếp
Hợp chất Z tạo bởi 2 nguyên tố M, R có công thức MaRb trong đó R chiếm 6,667% khối lượng. Trong hạt nhân nguyên tử M có số nơtron nhiều hơn số proton 4 hạt; còn trong hạt nhân R có số nơtron bằng số proton; tổng số hạt proton trong Z là 84 và a+b=4.
Khối lượng phân tử Z là
A. 67
B. 161
C. 180
D. 92
Hợp chất Z tạo bởi 2 nguyên tố M, R có công thức
M
a
R
b
trong đó R chiếm 6,667% khối lượng. Trong hạt nhân nguyên tử M có số nơtron nhiều hơn số proton 4 hạt; còn trong hạt nhân R có số nơtron bằng số proton; tổng số hạt proton trong Z là 84 và
a
+
b
4
. Khối lượng phân tử Z là: A. 67 B. 161 C. 180 D. 92
Đọc tiếp
Hợp chất Z tạo bởi 2 nguyên tố M, R có công thức M a R b trong đó R chiếm 6,667% khối lượng. Trong hạt nhân nguyên tử M có số nơtron nhiều hơn số proton 4 hạt; còn trong hạt nhân R có số nơtron bằng số proton; tổng số hạt proton trong Z là 84 và a + b = 4 . Khối lượng phân tử Z là:
A. 67
B. 161
C. 180
D. 92
Hợp chất H có công thức là MAx, trong đó M chiếm 46,67% về khối lượng. M là kim loại, A là phi kim thuộc chu kì 3. Trong hạt nhân M có số hạt notron hơn số hạt proton là 4, trong hạt nhân của A có số proton và số notron bằng nhau. Tổng số proton trong là 58. Hai nguyên tố M và A là: A. Fe và S. B. Cr và Si C. Cr và S D. Fe và Si
Đọc tiếp
Hợp chất H có công thức là MAx, trong đó M chiếm 46,67% về khối lượng. M là kim loại, A là phi kim thuộc chu kì 3. Trong hạt nhân M có số hạt notron hơn số hạt proton là 4, trong hạt nhân của A có số proton và số notron bằng nhau. Tổng số proton trong là 58. Hai nguyên tố M và A là:
A. Fe và S.
B. Cr và Si
C. Cr và S
D. Fe và Si
M chiếm 46,67% về khối lượng:

Quan sát – phân tích: Hệ 5 ẩn gồm 4 phương trình không thể giải thông thường để tìm nghiện vì ta cần phải rút gọn nghiệm: Phương trình (2) chứa ẩn ZM và x. ZA từ phương trình (1); (3); (4) ta có thể đưa về 1 phương trình chứa 2 ẩn ZM và x
Z A → Đưa về hệ phương trình 2 ẩn.
Ta đưa được về hệ sau
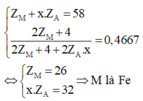
M là Fe nên x sẽ nhận giá trị từ 1 đến 3.
Từ x.ZA = 32 ta có các giá trị của ZA

Vậy H là FeS2
Đáp án A.
Đúng 0
Bình luận (0)
Hợp chất ion MX2 được tạo bởi ion M2+ và X–. Biết tổng các hạt cơ bản (p, n, e) trong MX2 là 180. Trong hạt nhân nguyên tử của M và X thì số hạt notron đều lớn hơn số hạt proton là 2 hạt. Số khối của M2+ lớn hơn số khối của X– là 20. Nguyên tử X là A. Lưu huỳnh (S). B. Clo (Cl). C. Cacbon (C). D. Brom (Br).
Đọc tiếp
Hợp chất ion MX2 được tạo bởi ion M2+ và X–. Biết tổng các hạt cơ bản (p, n, e) trong MX2 là 180. Trong hạt nhân nguyên tử của M và X thì số hạt notron đều lớn hơn số hạt proton là 2 hạt. Số khối của M2+ lớn hơn số khối của X– là 20. Nguyên tử X là
A. Lưu huỳnh (S).
B. Clo (Cl).
C. Cacbon (C).
D. Brom (Br).
gọi số proton của M và X tương ứng là x, y thì có NM = x + 2; NX = y + 2.
Từ giả thiết có: ∑hạt MX2 = (3x + 2) + 2.(3y + 2) = 180 (1);
lại chú ý rằng hiệu số số khối (p + n) nên đừng nhầm.!
Có hiệu số = 20 = (2x + 2) – (2y + 2) (2). Giải (1) và (2) được x = 26 và y = 16.
Vậy M là Fe và X là S.
đáp án đúng cần chọn là A.
Đúng 0
Bình luận (0)
Một hợp chất có công thức MAx (trong đó M chiếm 46,667% veef khối lượng). A là phi kim, M là kim loại ở chu kì 3 (13 số proton nguyên tử A 18). Trong hạt nhân của M có số notron nhiều hơn số proton là 4, trong hạt nhân của A có số notron bằng số proton. Tổng số proton trong MAx là 58. Xác định số proton, số notron, tên nguyên tố hóa học của M, A và công thức hóa học của MAx mình đang cần chiều nay, nhờ mọi người nhé
Đọc tiếp
Một hợp chất có công thức MAx (trong đó M chiếm 46,667% veef khối lượng). A là phi kim, M là kim loại ở chu kì 3 (13 < số proton nguyên tử A < 18). Trong hạt nhân của M có số notron nhiều hơn số proton là 4, trong hạt nhân của A có số notron bằng số proton. Tổng số proton trong MAx là 58. Xác định số proton, số notron, tên nguyên tố hóa học của M, A và công thức hóa học của MAx
mình đang cần chiều nay, nhờ mọi người nhé
Trong hợp chất MAx thì M chiếm 46,67% về khối lượng nên ta có:
\(\dfrac{M_X}{A}=\dfrac{46,67}{53,33}\)→\(\dfrac{n+p}{x\left(n'+p\right)}=\dfrac{7}{8}\)(1)
Thay n – p = 4 và n’ = p’ vào (1) ta có: \(\dfrac{2p+4}{2xp'}=\dfrac{7}{8}\)
Tổng số proton trong MAx là 58 nên p +xp’= 58 (2)
Giải (1) và (2) ta có p= 26 và xp’ = 32
Do A là phi kim ở chu kì 3 nên 15 ≤ p’≤17.
Vậy x =2 và p’=16 thỏa mãn
Vậy M là Fe và A là S. Công thức phân tử FeS2.
Đúng 1
Bình luận (0)