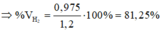Cho hỗn hợp A gồm H2 và Cl2. Chiếu sáng hỗn hợp A trong 1 thời gian thu được hỗn hợp B. Biết trong B HCl chiến 30% về khối lượng và lượng Cl2 giảm 20% so với ban đầu. Tính hiệu suất pứ, d B/a (các khí đo ở cùng điều kiện nhiệt độ và áp suất)

Những câu hỏi liên quan
Cho hỗn hợp A gồm H2 và Cl2. Chiếu sáng hỗn hợp A trong 1 thời gian thu được hỗn hợp B. Biết trong B HCl chiến 30% về khối lượng và lượng Cl2 giảm 20% so với ban đầu. Tính hiệu suất pứ, d B/a (các khí đo ở cùng điều kiện nhiệt độ và áp suất)
cho 12 lít hỗn hợp khí cl2 và h2 vào bình kín chiếu sáng thu đc hh khí chứa 30 %thể tích là khí sản phẩm, lượng cl còn dư 20 % so với ban đầu các khí ở cùng đk
b)tính hiệu suất phản ứng
Cho 1,2 lít hỗn hợp gồm hiđro và clo vào bình thủy tinh đậy kín và chiếu sáng bằng ánh sang khếch tán. Sau một thời gian, ngừng chiếu sáng thì thu được một hỗn hợp khí chứa 30% hiđroclorua về thể tích và hàm lượng clo ban đầu đã giảm xuống còn 20% so với lượng clo ban đầu. Thành phần phần trăm thể tích của hiđro trong hỗn hợp ban đầu bằng: A. 66,25% B. 30,75% C. 88,25% D. 81,25%
Đọc tiếp
Cho 1,2 lít hỗn hợp gồm hiđro và clo vào bình thủy tinh đậy kín và chiếu sáng bằng ánh sang khếch tán. Sau một thời gian, ngừng chiếu sáng thì thu được một hỗn hợp khí chứa 30% hiđroclorua về thể tích và hàm lượng clo ban đầu đã giảm xuống còn 20% so với lượng clo ban đầu. Thành phần phần trăm thể tích của hiđro trong hỗn hợp ban đầu bằng:
A. 66,25%
B. 30,75%
C. 88,25%
D. 81,25%
Cho m gam hỗn hợp Ca và Mg cháy hoàn toàn trong lượng vừa đủ 6,72 lít (đktc) hỗn hợp khí gồm O2, Cl2 có tỉ khối so với H2 là 29. Khi pứ kết thúc thu đc 31,8 g sản phẩm rắn gồm các oxit và muối clorua của 2 kim loại. Xác định giá trị m. Tính % khối lượng các kim loại trong hỗn hợp ban đầu
hỗn hợp A gồm cl2 và o2, cho biết 6,72 lít hỗn hợp A ở đktc có tỉ khối so với khí H2 là 29 a, tính thành phần % thể tích mỗi khí trong hỗn hợp A b, tính khối lượng mỗi khí có trong hỗn hợp trên
a) \(\left\{{}\begin{matrix}n_{Cl_2}+n_{O_2}=\dfrac{6,72}{22,4}=0,3\\\overline{M}=\dfrac{71.n_{Cl_2}+32.n_{O_2}}{n_{Cl_2}+n_{O_2}}=2.29=58\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}n_{Cl_2}=0,2\left(mol\right)\\n_{O_2}=0,1\left(mol\right)\end{matrix}\right.\)
\(\left\{{}\begin{matrix}\%V_{Cl_2}=\dfrac{0,2}{0,3}.100\%=66,67\%\\\%V_{O_2}=\dfrac{0,1}{0,3}.100\%=33,33\%\end{matrix}\right.\)
b) \(\left\{{}\begin{matrix}m_{Cl_2}=0,2.71=14,2\left(g\right)\\m_{O_2}=0,1.32=3,2\left(g\right)\end{matrix}\right.\)
Đúng 2
Bình luận (0)
hỗn hợp khí a gồm n2 và h2 có tỉ khối đối với h2 là 3 6. nung nóng một thời gian sau đó đưa về nhiệt độ ban đầu thu được hỗn hợp khí B gồm 3 khí N2, H2 và NH3 có tỉ khối đối với H2 bằng 4,5.
a, Tính % về thể tích mỗi khí trong A và B.
b, Tính hiệu suất phản ứng
\(n_A=1\left(mol\right)\)
\(n_{N_2}=a\left(mol\right),n_{H_2}=b\left(mol\right)\)
\(\Leftrightarrow a+b=1\left(1\right)\)
\(m_A=28a+2b=7.2\left(g\right)\left(2\right)\)
\(\left(1\right)\left(2\right):a=0.2,b=0.8\)
\(\%N_2=20\%,\%H_2=80\%\)
\(n_{N_2\left(pư\right)}=a\left(mol\right)\)
\(N_2+3H_2⇌2NH_3\)
\(0.2......0.8\)
\(a.......3a.........2a\)
\(0.2-a.0.8-3a....2a\)
\(M_B=\dfrac{\left(0.2-a\right)\cdot28+\left(0.8-3a\right)\cdot2+2a\cdot17}{0.2-a+0.8-3a+2a}=9\)
\(\Leftrightarrow a=0.1\)
\(\%N_2=12.5\%\)
\(\%H_2=62.5\%\)
\(\%NH_3=25\%\)
\(H\%=\dfrac{0.1}{0.2}\cdot100\%=50\%\)
Đúng 5
Bình luận (0)
Coi $n_A = 1(mol)$
Gọi $n_{N_2} = a ; n_{H_2} = b$
$M_A = 3,6.2 = 7,2$
Ta có:
$a + b = 1$
$28a + 2b = 7,2(a + b)$
Suy ra a = 0,2; b = 0,8
Vậy $\%V_{N_2} = \dfrac{0,2}{1}.100\% = 20% ; \%V_{H_2} = 80\%$
Gọi hiệu suất là a
$N_2 + 3H_2 \xrightarrow{t^o,xt} 2NH_3$
Ta thấy : $n_{N_2} : 1 < n_{H_2} : 3$ nên hiệu suất tính theo $N_2$
$n_{N_2\ pư} = 0,2a(mol)$
Theo PTHH :
$n_{H_2\ pư} = 0,6a(mol) ; n_{NH_3} = 0,4a(mol)$
$m_B = m_A = 7,2(gam)$
$\Rightarrow n_B = \dfrac{7,2}{4,5.2} = 0,8$
Khí B gồm :
$N_2 : 0,2 - 0,2a(mol)$
$H_2 : 0,8 - 0,6a(mol)$
$NH_3 : 0,4a(mol)$
Suy ra : 0,2 - 0,2a + 0,8 - 0,6a + 0,4a = 0,8
Suy ra a = 0,5 = 50%
Vậy B gồm :
$N_2 : 0,1(mol)$
$H_2 : 0,5(mol)$
$NH_3 : 0,2(mol)$
$\%V_{N_2} = \dfrac{0,1}{0,8}.100\% = 12,5\%$
$\%V_{H_2} = \dfrac{0,5}{0,8}.100\% = 62,5\%$
$\%V_{NH_3} = 25\%$
Đúng 4
Bình luận (0)
C1: Cho 10.8 g hỗn hợp gồm Mg và Fe tác dụng với 102.2 g dung dịch HCl 20% thu được dung dịch A và 5.6 l khí- tính % khối lượng của mỗi kim loại trong hỗn hợp- tính % nồng độ các chất trong dung dịch A- cho dung dịch A tác dụng với lượng dư dung dịch AgNO3. tính khối lượng kết tủa.C2: cho 1.74 g hỗn hợp A gồm nhôm và magie tác dụn vừa đủ 100ml dung dịch HCl có D 1.05 g/ml, thu được 1.792l H2 và dung dịch X.- tính % khối lượng của nhôm- cho dung dịch X tác dụng vừa đủ 50 g dung dịch AgNO3 thu đư...
Đọc tiếp
C1: Cho 10.8 g hỗn hợp gồm Mg và Fe tác dụng với 102.2 g dung dịch HCl 20% thu được dung dịch A và 5.6 l khí
- tính % khối lượng của mỗi kim loại trong hỗn hợp
- tính % nồng độ các chất trong dung dịch A
- cho dung dịch A tác dụng với lượng dư dung dịch AgNO3. tính khối lượng kết tủa.
C2: cho 1.74 g hỗn hợp A gồm nhôm và magie tác dụn vừa đủ 100ml dung dịch HCl có D = 1.05 g/ml, thu được 1.792l H2 và dung dịch X.
- tính % khối lượng của nhôm
- cho dung dịch X tác dụng vừa đủ 50 g dung dịch AgNO3 thu được dung dịch Y. Tính C% dung dịch Y
C3: hòa tan hoàn toàn 10.3 gam hỗn hợp Mg và MgCO3 trong 100g dung dịch HCl 18.25% thu được dung dịch X và 4.48l hỗn hợp khí Y
- tính % khối lượng mỗi chất trong hỗn hợp ban đầu
- tính nồng độ % của các chất trong dung dịch X
- cho toàn bộ lượng khí H2 trong Y tác dụng với 1.68 l khí Cl2 (hiệu suất phản ứng 80%) rồi hấp thụ toàn bộ sản phẩm thu được vào dung dịch AgNO3 dư thì thu được bao nhiêu gam kết tủa?
Cho 32g hỗn hợp gồm mg và mgo tác dụng vừa đủ hết với dd hcl 7.3% sau pứ người ta thu được 22.4 lít khí ở đktc. a) tính phần trăm khối lượng mỗi chất trong hỗn hợp ban đầu. b)tính khối lượng dd hcl cần dùng cho các pứ trên. C) tính nồng độ phần trăm của chất có trong dd sau khi pứ kết thúc.
Câu 6:Cho 9 gam hỗn hợp gồm Al và Cu tác dụng với lượng dư dung dịch HCl nồng độ 20% . Sau phản ứng thu được 1,344 lít khí (ở đktc).
a, Tính % về khối lượng các kim loại trong hỗn hợp ban đầu
b,Tính khối lượng dung dịch HCl đã dùng . Biết rằng lượng dung dịch HCl đã dùng được lấy dư 10% so với lượng cần thiết cho phản ứng.