trong tinh thể cu cu chiếm 68% thể tích tinh thể còn lại là khe trống biết rằng bán kính ntuwr đồng bằng 10^-9 c và NTKtb Cu=64,2 tính KLR Cu

Những câu hỏi liên quan
Tính bán kính gần đúng của nguyên tử canxi biết thể tích của 1 mol canxi tinh thể bằng 25,87 cm3.
(Cho biết: Trong tinh thể, các nguyên tử canxi chỉ chiếm 74% thể tích, còn lại là khe trống).
Thể tích của 1 nguyên tử Ca :
\(V_{\text{Nguyên tử Ca}}=\dfrac{25.87}{6\cdot10^{23}}\cdot\dfrac{74}{100}=3.19\cdot10^{-23}\left(cm^3\right)\)
\(\Rightarrow r=\sqrt[3]{\dfrac{3V}{4\pi}}=\sqrt[3]{\dfrac{3\cdot3.19\cdot10^{-23}}{4\pi}}=1.96\cdot10^{-8}\left(cm\right)\)
Đúng 1
Bình luận (0)
Tính bán kính gần đúng của nguyên tử canxi biết thể tích của 1 mol canxi tinh thể bằng 25,87 cm3.
(Cho biết: Trong tinh thể, các nguyên tử canxi chỉ chiếm 74% thể tích, còn lại là khe trống).
1 mol chứa khoảng 6,02.1023 nguyên tử nên thể tích của 1 nguyên tử canxi là
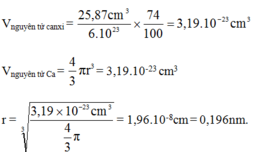
Đúng 0
Bình luận (0)
a) Nguyên tử của nguyên tố X có tổng các hạt là 52, trong đó tổng số hạt mang điện nhiều hơn số hạt không mang điện là 16. Xác định số lượng mỗi loại hạt trong nguyên tử X và bộ số lượng tử của electron cuối cùng trong nguyên tử X.b) Tính bán kính gần đúng của Cu ở 200C biết ở nhiệt độ đó khối lượng riêng của Cu là 8,93 g/cm3 với giả thiết trong tinh thể các nguyên tử Cu là những hình cầu chiếm 74% thể tích tinh thể, phần còn lại là khe trống. Cho khối lượng của Cu là 63,5u.
Đọc tiếp
a) Nguyên tử của nguyên tố X có tổng các hạt là 52, trong đó tổng số hạt mang điện nhiều hơn số hạt không mang điện là 16. Xác định số lượng mỗi loại hạt trong nguyên tử X và bộ số lượng tử của electron cuối cùng trong nguyên tử X.
b) Tính bán kính gần đúng của Cu ở 200C biết ở nhiệt độ đó khối lượng riêng của Cu là 8,93 g/cm3 với giả thiết trong tinh thể các nguyên tử Cu là những hình cầu chiếm 74% thể tích tinh thể, phần còn lại là khe trống. Cho khối lượng của Cu là 63,5u.
a) Có p + n + e = 52
<=> 2p + n = 52 (1)
Lại có p + e - n = 16
<=> 2p - n = 16 (2)
Từ (2) (1) => HPT : \(\hept{\begin{cases}2p+n=52\\2p-n=16\end{cases}}\Leftrightarrow\hept{\begin{cases}p=e=17\\n=18\end{cases}}\)
18 nha
MMMMMM
@@
HT
Nguyên tử X có tổng các hạt là 52 : 2Z + N = 52
Số hạt mang điện nhiều hơn số hạt không mang điện là 16 hạt : 2Z-N=16
=> {Z=17N=18{Z=17N=18
Vậy: Số P=Số E = Z = 17
Số N = 18
Cho 12,8 g tinh thể Cu có V=11cm3 . Trong tinh thể nguyên tử Cu chiếm 74%V, còn lại là khe trống . Tính r nguyên tử Cu???
Mọi người hãy giúp e bài này đi ạ. Em cảm ơn.
Nguyên tử Al có bán kính 1,43 Å và có nguyên tử khối là 27u. Khối lượng riêng của Al bằng bao nhiêu, biết rằng trong tinh thể nhôm các nguyên tử chỉ chiếm 74% thể tích, còn lại là các khe trống? A. 1,96 B. 2,7 C. 3,64 D. 1,99
Đọc tiếp
Nguyên tử Al có bán kính 1,43 Å và có nguyên tử khối là 27u. Khối lượng riêng của Al bằng bao nhiêu, biết rằng trong tinh thể nhôm các nguyên tử chỉ chiếm 74% thể tích, còn lại là các khe trống?
A. 1,96
B. 2,7
C. 3,64
D. 1,99
Đáp án B.
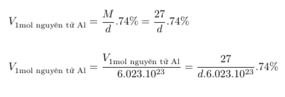
Mặt khác:
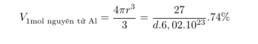
Suy ra: D = 2,7 gam/cm3
Đúng 1
Bình luận (0)
Khối lượng riêng của đồng kim loại là 8,98 g/cm3. Gỉa thiết rằng trong tinh thể đồng các nguyên tử là những hình cầu chiếm 74% thể tích tinh thể, phần còn lại là khe rỗng. Bán kính nguyên tử đồng tính theo lí thuyết là: A. 0,135 nm B. 0,100 nm C. 0,080 nm D. 0,128 nm
Đọc tiếp
Khối lượng riêng của đồng kim loại là 8,98 g/cm3. Gỉa thiết rằng trong tinh thể đồng các nguyên tử là những hình cầu chiếm 74% thể tích tinh thể, phần còn lại là khe rỗng. Bán kính nguyên tử đồng tính theo lí thuyết là:
A. 0,135 nm
B. 0,100 nm
C. 0,080 nm
D. 0,128 nm
Tính bán kính gần đúng của Ag ở 20oC biết ở nhiệt đọ đó khối lượng riêng của Ag là 19,23g/cm3. Giả thiết trong tinh thể Ag là hình cầu chiếm 75% thể tích còn lại là khe trống. Biết mAg= 196,97g.
tinh thể Ag chiếm 75 % thể tích => khối lượng riêng của nguyên tử Ag = 19,23/0,75= 25,64 (g/cm3)
áp dụng ct : V = \(\frac{4\sqcap r^3}{3}\) => r = ³√[(196,97.1,66.10^-24/25,64) /(4π/3)] cm
Đúng 0
Bình luận (0)
Khối lượng riêng của Cu là 8,93g/cm3 và khối lưọng nguyên tử Cu là 63,546 đvC. Mặt khác thể tích thật chiếm bởi các nguyên tử Cu chỉ = 74% tinh thể, còn lại là các khe trống. Tính bán kính gần đúng của nguyên tử Cu
ta có: mCu= 63,546. 1,6605. 10^-24= 1,055.10^-22 (1,6605.10^-27 kg=1,6605.10^-24 g)
Theo công thức: DCu= mCu/ VCu <=> VCu= mCu/DCu=1,055.10^-22/8,93=1,18.10^-23 (D là khối lượng riêng)
Vì thể tích thật chỉ chiếm 74% tinh thể => VCu thật= 1,18.10^-23.0,74= 8,732.10^-24
VCu= 4/3.3,14.r^3 => r= 1,28. 10^-8 cm
Đúng 1
Bình luận (0)
Cấu trúc tinh thể của nguyên tử Cr là lập phương tâm khối (nguyên tử và các ion kim loại chỉ chiếm 68%, còn lại 32% là không gian trống), giả thiết rằng trong tinh thể các nguyên tử Cr là những hình cầu, phần còn lại là các khe rỗng. Khối lượng riêng của Cr là 7,19g/cm3 và nguyên tử khối là 51,9961. Bán kính nguyên tử gần đúng của Cr là A. 1,25
A
0
B.1,52
A
0
C.1,07...
Đọc tiếp
Cấu trúc tinh thể của nguyên tử Cr là lập phương tâm khối (nguyên tử và các ion kim loại chỉ chiếm 68%, còn lại 32% là không gian trống), giả thiết rằng trong tinh thể các nguyên tử Cr là những hình cầu, phần còn lại là các khe rỗng. Khối lượng riêng của Cr là 7,19g/cm3 và nguyên tử khối là 51,9961. Bán kính nguyên tử gần đúng của Cr là
A. 1,25 A 0
B.1,52 A 0
C.1,07 A 0
D.1,17 A 0

















