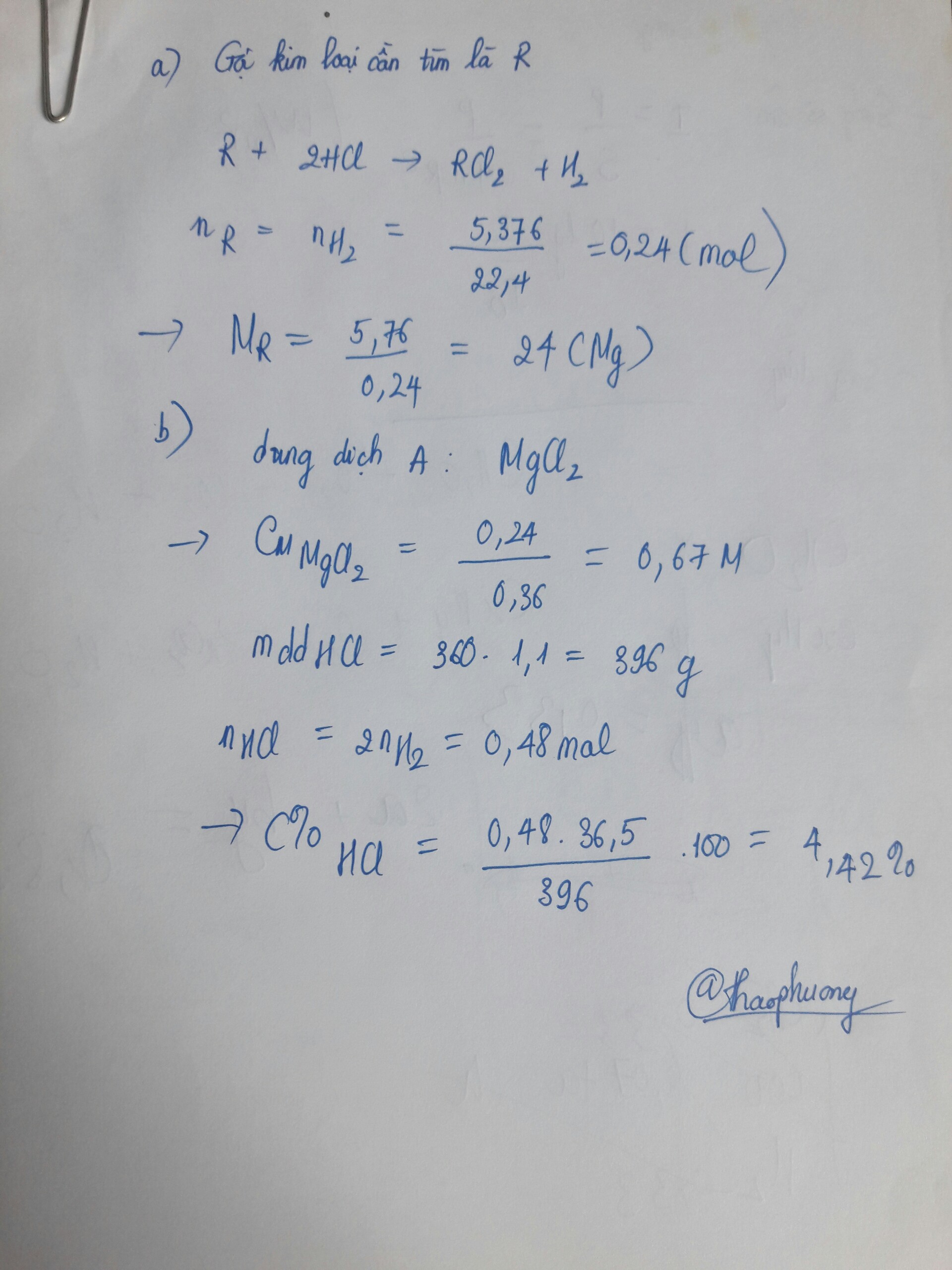khi cho 3,1 g hỗn hợp 2 kim loại kiềm A,B tác dụng vs 47 g nước thấy có x l khí thoát ra.dung dịch thu đc có tổng nồng độ phần trăm của chất tan 9,6%.giá trị x.

Những câu hỏi liên quan
Cho 5,76 g kim loại kiềm thổ tác dụng với 360ml dung dịch HCl C% (d=1,1g/ml) thu được 5,376 lít khí
(đktc) và dung dịch A.
a. Tìm tên kim loại?
b. Xác định nồng độ phần trăm của các chất tan trong dung dịch A và giá trị C%.
Hỗn hợp X gồm M2CO3, MHCO3 và MCl với M là kim loại kiềm. Nung nóng 20,29 gam hỗn hợp X, sau khi phản ứng xảy ra hoàn toàn thấy còn lại 18,74 g chất rắn. Nếu lấy 20,29 g hỗn hợp X trên tác dụng hết với 500 ml dung dịch HCl 1M thì thoát ra 3,36 lít khí (đktc) và thu được dung dịch Y. Cho Y tác dụng với dung dịch AgNO3 dư thì thu được 74,62 g kết tủa. Phần trăm khối lượng của kim loại M trong MCl gần đúng với A. 39% B. 16% C. 70% D. 52%
Đọc tiếp
Hỗn hợp X gồm M2CO3, MHCO3 và MCl với M là kim loại kiềm. Nung nóng 20,29 gam hỗn hợp X, sau khi phản ứng xảy ra hoàn toàn thấy còn lại 18,74 g chất rắn. Nếu lấy 20,29 g hỗn hợp X trên tác dụng hết với 500 ml dung dịch HCl 1M thì thoát ra 3,36 lít khí (đktc) và thu được dung dịch Y. Cho Y tác dụng với dung dịch AgNO3 dư thì thu được 74,62 g kết tủa. Phần trăm khối lượng của kim loại M trong MCl gần đúng với
A. 39%
B. 16%
C. 70%
D. 52%
Đáp án C
Đặt số mol của M2CO3, MHCO3, MCl là x,y,z mol
Đun nóng X :
2MHCO3 → M2CO3 + H2O + CO2
mrắn giảm = 18. y/ 2 + 44.y/2 =20,29 -18,74 → y = 0,05 mol
X tác dụng với 0,5 mol HCl :
M2CO3 + 2HCl → 2MCl + H2O + CO2
MHCO3 + HCl → MCl + H2O + CO2
nCO2 = x + y = 0,15 → x =0,1mol → nHCl phản ứng = 2.0,1 + 0,05 =0,25 mol < nHCl ban đầu
→ HCl dư
Dd Y có MCl và có thể có HCl dư
Ag+ + Cl- → AgCl
0,52 mol
→ nCl- = 0,52 = nHCl + nMCl (ban đầu) = 0,5 + z → z = 0,02 mol
Ta có mX = 0,1 (2M + 60) + 0,05 ( M + 61) + 0,02 (M + 35,5) → M = 39 (K)
Trong KCl thì %K = 39/74,5 .100% =52,35 %
Đúng 0
Bình luận (0)
Cho 1,82 g một kim loại kiềm tác dụng hết với 48,44 gam nước, sau phản ứng thu được 2,912 lít khí H 2 (đktc) và dung dịch X. Kim loại kiềm và nồng độ phần trăm dung dịch X là
A. Li; 44%
B. Na; 31,65 %
C. Li; 12,48 %
D. Na; 44%
Một hỗn hợp gồm ba kim loại K , Cu , Fe cho tác dụng với nước lấy dư thì thu đc dd A , hỗn hợp chất rắn B và 22,4 l khí C (đktc) . Cho B tác dụng vừa đủ với 400ml dd HCl nồng độ 0,5M sau phản ứng còn lại 6,6 g chất rắna) Tính thành phần phần trăm m mỗi kim loại trong hỗn hợp ban đầu :????b) Khí C thu được tác dụng vừa đủ với 5,8g oxit sắt ở nhiệt độ cao. XĐ CTHH của oxit sắt
Đọc tiếp
Một hỗn hợp gồm ba kim loại K , Cu , Fe cho tác dụng với nước lấy dư thì thu đc dd A , hỗn hợp chất rắn B và 22,4 l khí C (đktc) . Cho B tác dụng vừa đủ với 400ml dd HCl nồng độ 0,5M sau phản ứng còn lại 6,6 g chất rắn
a) Tính thành phần phần trăm m mỗi kim loại trong hỗn hợp ban đầu :????
b) Khí C thu được tác dụng vừa đủ với 5,8g oxit sắt ở nhiệt độ cao. XĐ CTHH của oxit sắt
a,\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(n_{HCl}=0,5.0,4=0,2\left(mol\right)\)
PTHH: 2K + 2H2O ---> 2KOH + H2 (Fe và Cu ko tan trong nước)
0,2 0,1
Fe + 2HCl ---> FeCl2 + H2 (Cu ko phản ứng với HCl)
0,1 0,2
mChất rắn còn lại = mCu = 6,6 (g)
\(\rightarrow\left\{{}\begin{matrix}m_K=39.0,2=7,8\left(g\right)\\m_{Fe}=56.0,1=5,6\left(g\right)\\m_{Cu}=6,6\left(g\right)\end{matrix}\right.\)
\(\rightarrow m_{\text{hhkimloại}}=7,8+5,6+6,6=20\left(g\right)\\ \rightarrow\left\{{}\begin{matrix}\%m_K=\dfrac{7,8}{20}=39\%\\\%m_{Fe}=\dfrac{5,6}{20}=28\%\\\%m_{Cu}=100\%-39\%-28\%=33\%\end{matrix}\right.\)
b, PTHH: FexOy + yH2 --to--> xFe + yH2O
\(n_{O\left(\text{trong oxit}\right)}=n_{H_2O}=n_{H_2}=0,1\left(mol\right)\\ \rightarrow n_{Fe\left(\text{trong oxit}\right)}=\dfrac{5,8-0,1.16}{56}=0,075\left(mol\right)\)
\(\rightarrow x:y=n_{Fe}:n_O=0,075:0,1=3:4\)
CTHH của oxit sắt Fe3O4
Sửa đề thành 2,24 l khí C nhé :)
Đúng 2
Bình luận (0)
Cho 8,4 g kim loại Fe tác dụng vừa đủ 245g dung dịch H2SO4 a Viết pthh của phản ứng b tính thể tích của khí hiđro thoát ra ở đktc c tính nồng độ phần trăm của dung dịch axit cần dùng cho phản ứng d tính nồng độ phần trăm của chất tan có trong dung dịch phản ứng
Fe+H2SO4->FeSO4+H2
0,15---0,15-----0,15---0,15 mol
n Fe=8,4\56=0,15 mol
=>VH2=0,15.22,4=3,36l
=>m H2SO4=0,15.98=14,7g
=>C% H2SO4=14,7\245 .100=6%
=>m dd muối=8,4+245-0,15.2=253,1g
=>C% muối =0,15.152\253,1 .100=9%
Đúng 2
Bình luận (2)
Cho 3,25 g hỗn hợp X gồm một kim loại kiềm M và một kim loại A (hóa trị 2) tan hoàn toàn vào nước tạo thành dung dịch Y và 1,008 lít khí thoát ra. Chia dung dịch Y thành hai phần bằng nhau:
Phần 1 đem khô cạn dung dịch thu được 2,03 g chất rắn Z
Phần 2 cho tác dụng với 100 ml dung dich HCl 0,35 M tạo ra kết tủa.
Xác định CTHH của M và A
Hóa 9 nha m.n
M là Kali
A là Zn
(muốn chi tiết trên mạng có =))
vì kim loại tác dựng với nước nên kim loại là lưỡng tính
GỌI SỐ MOL CỦA M VÀ A LÀ x VÀ y
2M + H2O -> 2M(OH) + H2
2x x x
A + 2H2O -> A(OH) +H2
y y y
yMA + xMM =3,25 (1)
2x + y = 0,9 (2)
2M(OH) + A(OH) -> M2(AO2) + 2H2O
x 2y y
VẬY dd Y GỒM MOH DƯ (x-2y) VÀ M2(AO2) (y MOL)
CHIA THÀNH 2 PHẦN
(x-2y)(MM +17) /2 + y(2MM + MA +32) /2 =2,03
<-> xMM + yMA +17x -2y =4.06 (3)
THAY (1) VÀO (3) ĐƯỢC 3,25 +17x -2y = 4,06
<-> 17x -2y =0,81 (4)
KẾT HỢP 1 VÀ 4 ĐƯỢC 2x +y =0,9
VÀ 17x-2y =0,81
ĐẾN ĐÂY BẤM MÁY TÍNH TÌM x vÀ y
THAY x VÀ y vào (1) rồi tính
kết quả là Kali Và Kẽm
Trộn m gam hỗn hợp hai kim loại Fe, Zn với 9,6g bột S, thu được hỗn hợp X. Nung X trong bình kín thu được hỗn hợp Y. Hòa tan hết Y trong dung dịch H2SO4 đặc nóng thấy có 26,88l (đktc) khí SO2 thoát ra. Dung dịch thu được cho tác dụng với dung dịch NaOH dư, thấy có 10,7 g kết tủa xuất hiện. Tính giá trị của m.
Cho 6,06 gam hỗn hợp X gồm một kim loại kiềm M và một kim loại R có hóa trị III vào nước, thấy hỗn hợp X tan hoàn toàn tạo ra dung dịch A và 3,808 lít khí (đktc). Chia dung dịch A làm hai phần bằng nhau: – Cô cạn phần thứ nhất thu được 4,48 gam chất rắn khan. – Thêm V lít dung dịch HCl 1M vào phần thứ hai thấy xuất hiện 0,78 gam kết tủa. a. Xác định tên hai kim loại và tính thành phần % khối lượng mỗi kim loại trong X. b. Tính giá trị V.
Đọc tiếp
Cho 6,06 gam hỗn hợp X gồm một kim loại kiềm M và một kim loại R có hóa trị III vào nước, thấy hỗn hợp X tan hoàn toàn tạo ra dung dịch A và 3,808 lít khí (đktc). Chia dung dịch A làm hai phần bằng nhau:
– Cô cạn phần thứ nhất thu được 4,48 gam chất rắn khan.
– Thêm V lít dung dịch HCl 1M vào phần thứ hai thấy xuất hiện 0,78 gam kết tủa.
a. Xác định tên hai kim loại và tính thành phần % khối lượng mỗi kim loại trong X.
b. Tính giá trị V.
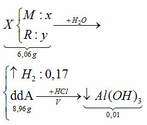
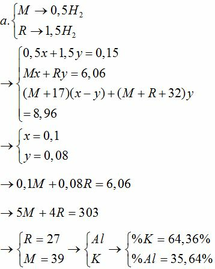
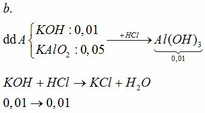
TH1: kết tủa Al(OH)3 chưa bị hòa tan
KAlO2 + HCl +H2O → KCl + Al(OH)3↓
0,01 ←0,01
→ nHCl = 0,02
→ V = 0,02 (lít) = 20 (ml)
TH2: kết tủa Al(OH)3 bị hòa tan một phần
KAlO2 + HCl +H2O → KCl + Al(OH)3↓
0,05 → 0,05 0,05
Al(OH)3 + 3HCl → AlCl3 + 3H2O
0,04` → 0,12
→ nHCl = 0,18 → V = 0,18 (l) = 180 (ml)
Vậy có 2 giá trị của V thỏa mãn là: 20 ml và 180 ml
Đúng 0
Bình luận (0)
Khi cho 2,4 g kim loại magie tác dụng với 200 dung dịch HCL thấy thanh mg tan dần và có khí thoát ra a.tính thể tích khí sinh ra ở điều kiện tiêu chuẩn b. tính khối lượng muối tạo thành c. dung dịch tạo thành có nồng độ bao nhiêu phần trăm d. nếu dùng lượng khí trên tác dụng với 16 g bột đồng oxit thì tạo ra bao nhiêu gam kim loại chất nào còn dư và dư bao nhiêu gam
\(Mg+2HCl\rightarrow MgCl_2+H_2\\ n_{Mg}=\dfrac{2,4}{24}=0,1\left(mol\right)\\ n_{H_2}=n_{MgCl_2}=n_{Mg}=0,1\left(mol\right)\\ a,V_{H_2\left(đktc\right)}=0,1.22,4=2,24\left(l\right)\\ b,m_{MgCl_2}=95.0,1=9,5\left(g\right)\\ c,m_{ddMgCl_2}=m_{Mg}+m_{ddHCl}-m_{H_2}=2,4+200-0,1.2=202,2\left(g\right)\\ C\%_{ddMgCl_2}=\dfrac{9,5}{202,2}.100\approx4,698\%\\ d,n_{CuO}=\dfrac{16}{80}=0,2\left(mol\right)\\ PTHH:H_2+CuO\rightarrow\left(t^o\right)Cu+H_2O\\ Vì:\dfrac{0,2}{1}>\dfrac{0,1}{1}\Rightarrow CuOdư\\ n_{CuO\left(dư\right)}=0,2-0,1.1=0,1\left(mol\right)\\ m_{CuO\left(dư\right)}=0,1.80=8\left(g\right)\)
Đúng 1
Bình luận (0)