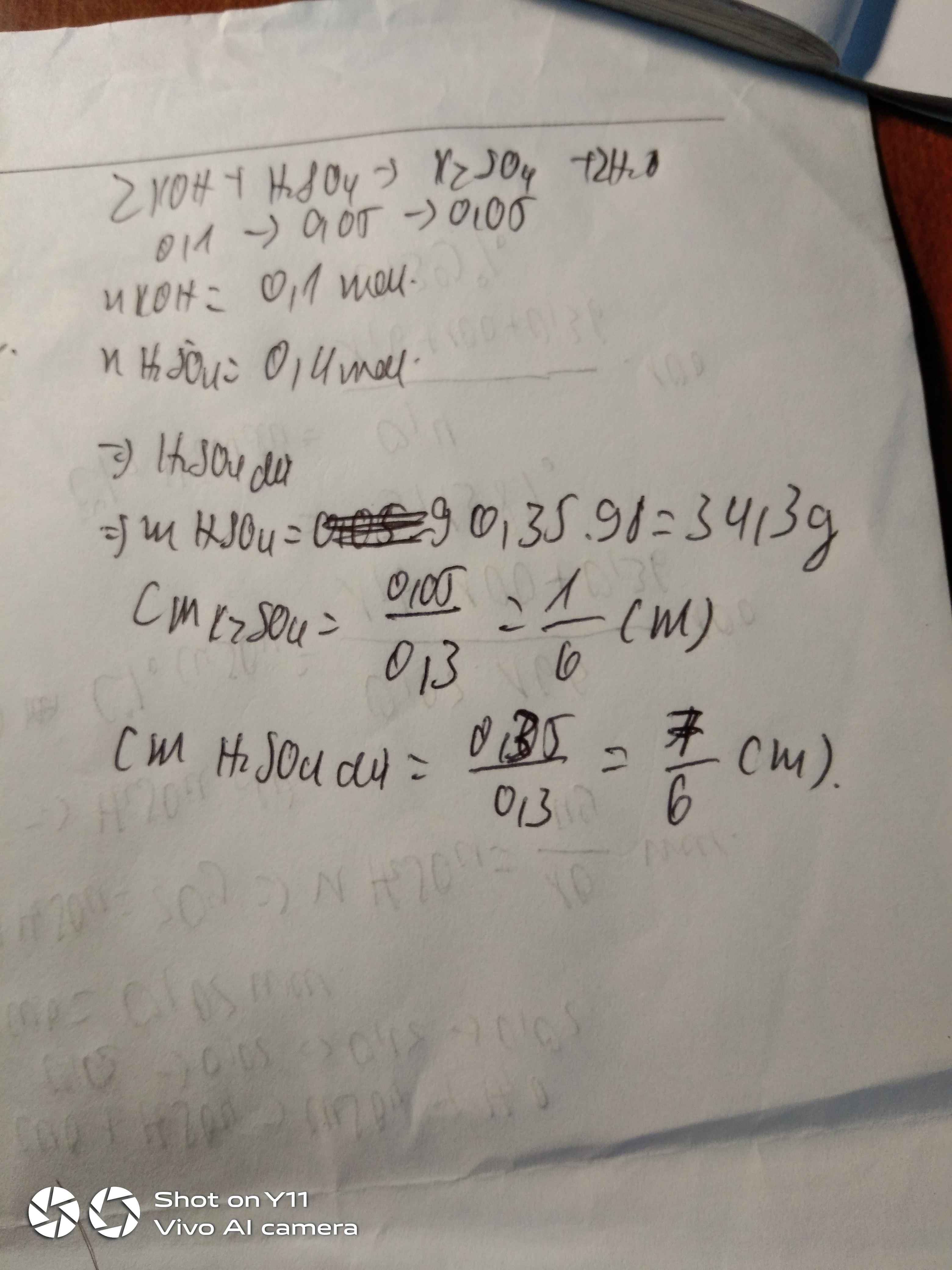thể tích dd NaCl 1M cần đẻ phản ứng vừa đủ với 100ml dd AgNO3 2M là

Những câu hỏi liên quan
Một amino axit A có chứa 2 nhóm chức amin, một nhóm chức axit. 100ml dd có chứa A với nồng độ 1M phản ứng vừa đủ với 100ml dd HCl aM được dd X, dd X phản ứng vừa đủ với 100ml dd NaOH bM. Giá trị của a, b lần lượt là
Cho 200g dd AgNO3 tác dụng vừa đủ với 200 g dd NaCl, sau phản ứng thu được 14,35g kết tủa trắng
a. Tính nồng độ % dd AgNO3
b. Tính nồng độ % dd NaCl
cho 100ml dd CuCl2 2M tác dụng vừa đủ với V lít dung dịch NaOH 1M
a) tính khối lượng kết tủa thu được
b) tính nồng độ mol dd thu được sau phản ứng
c) hòa tan hoàn toàn lượng kết tủa trên bằng dd HCl 2M (d=1,1g/mol)
tính khối lượng dd HCl cần dùng
C là dung dịch h2so4 nồng độ x mol/l , D là dd koh nồng độ y mol/l . trộn 200ml dd C với 300ml dd D thu được 500ml dd E. để trung hòa 100ml dd E cần dùng 40ml h2so4 1m. mặt khác trộn 300ml dd C với 200ml dd D thu đươc 500ml dd F . xác định x,y biết rằng 100ml dd F phản ứng vừa đủ với 2.04g Al2o3
Nồng độ 100ml dd NaOH cần dùng để phản ứng vừa đủ với 200ml dd HCl 0,05M là bao nhiêu?
$NaOH + HCl \to NaCl + H_2O$
Theo PTHH :
$n_{NaOH} = n_{HCl} = 0,2.0,05 = 0,01(mol)$
$C_{M_{NaOH}} = \dfrac{0,01}{0,1} = 0,1M$
Đúng 1
Bình luận (1)
cho 6,5g kẽm phản ứng vừa đủ với 100ml dd HCL
a. tính thể tích h2 thu được ở đktc
b.tính nồng độ mol của dd HCL đã dùng
\(n_{Zn}=\dfrac{6.5}{65}=0.1\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(0.1........0.2....................0.1\)
\(V_{H_2}=0.1\cdot22.4=2.24\left(l\right)\)
\(C_{M_{HCl}}=\dfrac{0.2}{0.1}=2\left(M\right)\)
Đúng 1
Bình luận (0)
A là dd h2so4 nồng độ aM . trộn 500ml dd A với 200ml dd koh 2M , thu được dd D. biết 1/2 dd D phản ứng vừa đủ 0.39 g al(oh)3 .
a, tìm A ?
b, hòa tan hết 2.688 g hỗn hợp B gồm fe3o4 và feco3 cần đủ 100ml dd A. xác định khối lượng từng chất trong hỗn hợp B
a)
nH2SO4 = 0.5a (mol)
nKOH = 0.4 (mol)
nAl(OH)3 = 0.005 (mol)
Trường hợp 1: H2SO4 dư
H2SO4 + 2KOH -----> K2SO4 + 2H2O
_0.2_____0.4_
nH2SO4dư = 0.5a - 0.2 (mol) => 1/2nH2SO4dư = 0.25a - 0.1 (mol)
2Al(OH)3 + 3H2SO4 -----> Al2(SO4)3 + 6H2O
_0.005____0.0075_
=> 0.25a - 0.1 = 0.0075 => a = 0.43
Trường hợp 2: KOH dư
H2SO4 + 2KOH -----> K2SO4 + 2H2O
_0.5a_____a_
nKOHdư = 0.4 - a (mol) => 1/2nKOHdư = 0.2 - 0.5a (mol)
Al(OH)3 + KOH -----> KAlO2 + 2H2O
_0.005__0.005_
=> 0.2 - 0.5a = 0.005 => a = 0.39
b)
Vì ddA td với Fe3O4 và FeCO3 => ddA có chứa H2SO4 dư, chọn TH1: a = 0.43
=> nH2SO4 trong 100ml ddA = 0.1x0.43 = 0.043 (mol)
Fe3O4 + 4H2SO4 -----> FeSO4 + Fe2(SO4)3 + 4H2O
__x_______4x_
FeCO3 + H2SO4 -----> FeSO4 + H2O + CO2
__y_______y_
mhhB = 2.668 (g) => 232x + 116y = 2.668
nH2SO4 = 0.043 (mol) => 4x + y = 0.043
=> x = 0.01; y = 0.003
mFe3O4 = 2.32 (g)
mFeCO3 = 0.348 (g)
Đúng 1
Bình luận (3)
Trộn 100ml dd Ba(No3)2 2M tác dụng vừa đủ với 150 ml dd H2SO4 1M. Tính khối lượng kết tủa thu được
100ml = 0,1l
150ml = 0,15l
\(n_{Ba\left(NO3\right)2}=2.0,1=0,2\left(mol\right)\)
\(n_{H2SO4}=1.0,15=0,15\left(mol\right)\)
Pt : \(Ba\left(NO_3\right)_2+H_2SO_4\rightarrow BaSO_4+2HNO_3|\)
1 1 1 2
0,2 0,15 0,15
Lập tỉ số so sánh : \(\dfrac{0,2}{1}>\dfrac{0,15}{1}\)
⇒ Ba(NO3)2 dư , H2SO4 phản ứng hết
⇒ Tính toán dựa vào số mol của H2SO4
\(n_{BaSO4}=\dfrac{0,15.1}{1}=0,15\left(mol\right)\)
⇒ \(m_{BaSO4}=0,15.233=34,95\left(g\right)\)
Chúc bạn học tốt
Đúng 1
Bình luận (0)
cho 100ml dd KOH 1M phản ứng với 200ml dd H2SO4 nồng độ 2M a) hỏi sau phản ứng chất nào dư, dư bao nhiêu b) tính nồng độ mol của dd sau phản ứng