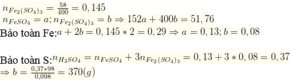Cho 8 gam sắt(III) oxit vào 50 gam dung dịch H2SO4 49%.Tính C% của dung dịch thu được sau phản ứng.

Những câu hỏi liên quan
Hòa tan hết a gam hỗn hợp X gồm Fe và một oxit sắt trong b gam dung dịch H2SO4 9,8% (lượng vừa đủ), sau phản ứng thu được dung dịch chứa 51,76 gam hỗn hợp hai muối khan. Mặt khác nếu hòa tan hết a gam X bằng dung dịch H2SO4 đặc nóng thì thu được duy nhất 58 gam muối Fe (III). Giá trị của b l A. 370 B. 220 C. 500 D. 420
Đọc tiếp
Hòa tan hết a gam hỗn hợp X gồm Fe và một oxit sắt trong b gam dung dịch H2SO4 9,8% (lượng vừa đủ), sau phản ứng thu được dung dịch chứa 51,76 gam hỗn hợp hai muối khan. Mặt khác nếu hòa tan hết a gam X bằng dung dịch H2SO4 đặc nóng thì thu được duy nhất 58 gam muối Fe (III). Giá trị của b l
A. 370
B. 220
C. 500
D. 420
Hòa tan hết a gam hỗn hợp X gồm Fe và một oxit sắt trong b gam dung dịch H2SO4 9,8% (lượng vừa đủ), sau phản ứng thu được dung dịch chứa 51,76 gam hỗn hợp hai muối khan. Mặt khác nếu hòa tan hết a gam X bằng dung dịch H2SO4 đặc nóng thì thu được duy nhất 58 gam muối Fe (III). Giá trị của b là: A. 370 B. 220 C. 500 D. 420
Đọc tiếp
Hòa tan hết a gam hỗn hợp X gồm Fe và một oxit sắt trong b gam dung dịch H2SO4 9,8% (lượng vừa đủ), sau phản ứng thu được dung dịch chứa 51,76 gam hỗn hợp hai muối khan. Mặt khác nếu hòa tan hết a gam X bằng dung dịch H2SO4 đặc nóng thì thu được duy nhất 58 gam muối Fe (III). Giá trị của b là:
A. 370
B. 220
C. 500
D. 420
Đáp án A
nFe = 2. 58/400 = 0,29 mol
nFeSO4 = x , nFe2(SO4)3 = y
⇒mdd = 152 x + 400y = 51,76
nFe = nFeSO4 +2.nFe2(SO4)3 = x+ 2y = 0,29
⇒x= 0,13 mol , y= 0,08 mol
BT S: nH2SO4 = nFeSO4 + 3Fe2(SO4)3 = 0,13 + 3.0,08 = 0,37
⇒b = 0,37.98/9,8% = 370g
Đúng 0
Bình luận (0)
Hòa tan hết a gam hỗn hợp X gồm Fe và một oxit sắt trong b gam dung dịch H2SO4 9,8% (lượng vừa đủ), sau phản ứng thu được dung dịch chứa 51,76 gam hỗn hợp hai muối khan. Mặt khác nếu hòa tan hết a gam X bằng dung dịch H2SO4 đặc nóng thì thu được duy nhất 58 gam muối Fe (III). Giá trị của b là: A. 370 B. 220 C. 500 D. 420
Đọc tiếp
Hòa tan hết a gam hỗn hợp X gồm Fe và một oxit sắt trong b gam dung dịch H2SO4 9,8% (lượng vừa đủ), sau phản ứng thu được dung dịch chứa 51,76 gam hỗn hợp hai muối khan. Mặt khác nếu hòa tan hết a gam X bằng dung dịch H2SO4 đặc nóng thì thu được duy nhất 58 gam muối Fe (III). Giá trị của b là:
A. 370
B. 220
C. 500
D. 420
Đáp án A
nFe2(SO4)3 = 58/400 = 0,145 mol
nFeSO4 = a ; nFe2(SO4)3 =b
⇒152a + 400b = 51,76
BT Fe: a + 2b = 0,145 . 2 = 0,29 ⇒ a= 0,13 mol; b= 0,08 mol
BT S: nH2SO4 = n FeSO4 + 3nFe2( SO4)3 = 0,13 + 3. 0,08 = 0,37
⇒b= 0,37 .98 /0,098 =370g
Đúng 0
Bình luận (0)
Cho 24g Sắt (III) oxit và 300g dung dịch H2SO4 19,6% sau khi phản ứng xong thì:
a) thu được mấy gam muối?
b) dung dịch sau khi phản ứng chứa chất gì? Nồng độ mấy %?
Cho 24g Sắt (III) oxit và 300g dung dịch H2SO4 19,6% sau khi phản ứng xong thì:
a) thu được mấy gam muối?
b) dung dịch sau khi phản ứng chứa chất gì? Nồng độ mấy %?
---
a) nFe2O3= 24/160= 0,15(mol)
mH2SO4= 300.19,6%=58,8(g) -> nFe2O3= 58,8/98= 0,6(mol)
PTHH: Fe2O3 + 3 H2SO4 -> Fe2(SO4)3 + 3 H2O
Ta có: 0,15/1 < 0,6/3
-> Fe2O3 p.ứ hết, H2SO4 dư. Tính theo nFe2O3.
=> nFe2(SO4)3= nFe2O3= 0,15(mol)
=> m(muối)= mFe2(SO4)3= 400.0,15= 60(g)
b) Dung dịch sau p.ứ gồm Fe2(SO4)3 và H2SO4(dư).
mH2SO4(dư)= (0,6-0,15.3).98=14,7(g)
mddsau=mddH2SO4 + mFe2O3 = 300+24= 324(g)
=> \(C\%ddFe2\left(SO4\right)3=\frac{60}{324}.100\approx18,519\%\\ C\%ddH2SO4\left(dư\right)=\frac{14,7}{324}.100\approx4,537\%\)
Đúng 0
Bình luận (0)
Cho 24g sắt (III) oxit và 300g dd H2SO4 19,6% sau khi phản ứng xong thì:
a) Thu được mấy gam muối?
b) Dung dịch X sau phản ứng chứa chất gì? Nồng độ mấy %?
Cho 24g sắt (III) oxit và 300g dd H2SO4 19,6% sau khi phản ứng xong thì:
a) Thu được mấy gam muối?
b) Dung dịch X sau phản ứng chứa chất gì? Nồng độ mấy %?
\(n_{Fe2O3}=\dfrac{24}{160}=0,15\left(mol\right)\)
\(m_{ct}=\dfrac{19,6.300}{100}=58,8\left(g\right)\)
\(n_{H2SO4}=\dfrac{58,8}{98}=0,6\left(mol\right)\)
Pt : \(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2|\)
1 3 1 3
0,15 0,6 0,15
a) Lập tỉ số so sánh : \(\dfrac{0,15}{1}< \dfrac{0,6}{3}\)
⇒ Fe2O3 phản ứng hết , H2SO4 dư
⇒ Tính toán dựa vào số mol của Fe2O3
\(n_{Fe2\left(SO4\right)3}=\dfrac{0,15.1}{1}=0,15\left(mol\right)\)
⇒ \(m_{Fe2\left(SO4\right)3}=0,15.400=60\left(g\right)\)
b) Dung dịch X sau phản ứng gồm : \(Fe_2\left(SO_4\right)_3\) va dung dịch \(H_2SO_4\) dư
\(n_{H2SO4\left(dư\right)}=0,6-\left(0,15.3\right)=0,15\left(mol\right)\)
⇒ \(m_{H2SO4\left(dư\right)}=0,15.98=14,7\left(g\right)\)
\(m_{ddspu}=24+300-324\left(g\right)\)
\(C_{Fe2\left(SO4\right)3}=\dfrac{60.100}{324}=18,52\)0/0
\(C_{H2SO4\left(dư\right)}=\dfrac{14,7.100}{324}=4,54\)0/0
Chúc bạn học tốt
Đúng 1
Bình luận (0)
Cho sắt tác dụng với 200 ml dung dịch H2 SO4 thu được 6,72 lít khí bay ra ở điều kiện tiêu chuẩn vào dung dịch FeSO4 a Tính khối lượng sắt tham gia phản ứng B Tính nồng độ mol dung dịch H2SO4 ban đầu C nếu cho lượng sắt ở trên phản ứng với 49 gam dung dịch H2SO4 40% tính nồng độ các dung dịch sau phản ứng
Sửa lại câu c .
\(n_{H_2SO_4}=\dfrac{49.40}{100}:98=0,2\left(mol\right)\)
\(PTHH:\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
trc p/u : 0,3 0,2
p/u : 0,2 0,2 0,2 0,2
sau : 0,1 0 0,2 0,2
-> Fe dư
\(m_{ddFeSO_4}=0,3.56+49-0,4=65,4\left(g\right)\) ( ĐLBTKL )
\(m_{FeSO_4}=0,2.152=30,4\left(g\right)\)
\(C\%=\dfrac{30,4}{65,4}.100\%\approx46,48\%\)
Đúng 2
Bình luận (0)
PTHH :
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
0,3 0,3 0,3 0,3
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(a,m_{Fe}=0,3.56=16,8\left(g\right)\)
\(b,C_M=\dfrac{n}{V}=\dfrac{0,3}{0,2}=1,5M\)
\(c,n_{H_2SO_4}=\dfrac{\dfrac{49.40}{100}}{98}=0,2\left(mol\right)\)
\(\rightarrow n_{FeSO_4}=n_{H_2SO_4}=0,2\left(mol\right)\)
\(m_{FeSO_4}=0,2.152=30,4\left(g\right)\)
\(m_{ddFeSO_4}=49+\left(0,2.56\right)-0,2.2=59,8\left(g\right)\)( định luật bảo toàn khối lượng )
\(C\%=\dfrac{30,4}{59,8}.100\%\approx50,84\%\)
Đúng 1
Bình luận (1)
/ Cho một lượng mạt sắt dư vào 200ml dung dịch H2SO4 loãng. Phản ứng xong thu được 4,48 lít (đktc) a/ Tính khối lượng sắt tham gia phản ứng. b/Tìm nồng độ dd H2SO4 đã dùng. c/ Nếu cho 250 gam dung dịch Ba(OH)2 17,1% vào dung dịch sau phản ứng thì khối lượng kết tủa BaSO4 thu được là bao nhiêu gam?
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2(mol)\\ Fe+H_2SO_4\to FeSO_4+H_2\\ \Rightarrow n_{Fe}=n_{H_2SO_4}=n_{Fe(OH)_2}=0,2(mol)\\ a,m_{Fe}=0,2.56=11,2(g)\\ b,C_{M_{H_2SO_4}}=\dfrac{0,2}{0,2}=1M\)
\(c,Ba(OH)_2+FeSO_4\to BaSO_4\downarrow+Fe(OH)_2\downarrow\\ n_{Ba(OH)_2}=\dfrac{250.17,1}{100.171}=0,25(mol)\\ LTL:\dfrac{0,2}{1}<\dfrac{0,25}{1}\Rightarrow Ba(OH)_2\text{ dư}\\ \Rightarrow n_{BaSO_4}=0,2(mol)\\ \Rightarrow m_{BaSO_4}=233.0,2=46,6(g)\)
Đúng 1
Bình luận (0)
Cho 1,12 gam sắt vào 50 ml dd H2SO4 1M.Sau phản ứng thu được dung dịch A và khí H2 (đktc). a) Tính V lít khí H2?
b) Tính thể tích dung dịch H2SO4 phản ứng.
c) Tính nồng độ mol của các chất trong dung dịch A.( Thể tích dung dịch không thay đổi đáng kể)
\(n_{Fe}=\dfrac{1,12}{56}=0,02\left(mol\right)\)
\(n_{H2SO4}=0,05.1=0,05\left(mol\right)\)
Pt : \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
a) Xét tỉ lệ : \(0,02< 0,05\Rightarrow H2SO4dư\)
Theo Pt : \(n_{FeSO4}=n_{H2}=n_{Fe}=0,02\left(mol\right)\)
\(\Rightarrow V_{H2\left(dktc\right)}=0,02.22,4=0,448\left(l\right)\)
b) \(n_{H2SO4\left(dư\right)}=0,05-0,02=0,03\left(mol\right)\)
\(V_{ddH2SO4\left(dư\right)}=\dfrac{0,03}{1}=0,03\left(l\right)=30\left(ml\right)\)
c) \(C_{MFeSO4}=\dfrac{0,02}{0,05}=0,4\left(M\right)\)
\(C_{MH2SO4\left(dư\right)}=\dfrac{\left(0,05-0,02\right)}{0,05}=0,6\left(M\right)\)
Chúc bạn học tốt
Đúng 0
Bình luận (1)