tính thể tích của 12.8g khí sunfurơ (SO2) ở 27*C, áp suất 2 atm
hóa học 8 ai giúp mk với
1 lượng khí 02 có thể tích 11.2l ở nhiệt độ 27•C và áp suất 1at tính thể tích của lượng khí trên ở điều kiện tiêu chuẩn ( t= 0•C , p= 1at)
Trạng thái 1: \(\left\{{}\begin{matrix}p_1=1atm\\V_1=11,2l\\T_1=27^oC=300K\end{matrix}\right.\)
Trạng thái sau: \(\left\{{}\begin{matrix}p_2=1atm\\V_2=???\\T_2=0^oC=273K\end{matrix}\right.\)
Quá trình khí lí tưởng: \(\dfrac{p_1V_1}{T_1}=\dfrac{p_2V_2}{T_2}\)
\(\Rightarrow\dfrac{1\cdot11,2}{300}=\dfrac{1\cdot V_2}{273}\)
\(\Rightarrow V_2=10,192l\)
Đốt cháy hoàn toàn 5,6 lít khí metan (CH4) trong khí oxi, sau phản ứng thu được khí sunfurơ (SO2) và nước. Biết các khí đo ở điều kiện tiêu chuẩn.
a. Viết PTHH xảy ra.
b. Tính thể tích khí oxi cần dùng.
c. Tính thể tích khí sunfurơ thu được.
Lưu huỳnh (S) cháy trong không khí sinh ra chất khí mùi hắc, gây ho đó là lưu huỳnh đioxit (khí sunfurơ) có công thức hóa học là SO2.
a) Viết phương trình hóa học của lưu huỳnh cháy trong không khí.
b) Biết khối lượng lưu huỳnh tham gia phản ứng là 1,6g. Hãy tìm.
-Thể tích khí sunfurơ sinh ra ở đktc.
-Thể tích không khí cần dùng ở đktc. Biết oxi chiếm 1/5 thể tích không khí.
a) Phương trình hóa học S + O2 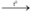 SO2
SO2
b) nS = 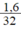 = 0,05 mol.
= 0,05 mol.
Theo phương trình trên, ta có:
nSO2 = nS = nO2 = 0,05 mol.
⇒ VSO2 = 0,05 .22,4 = 1,12 l.
⇒ VO2 = 22,4.0,05 = 1,12 l
Vì khí oxi chiếm 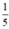 thể tích của không khí nên thể tích không khí cần là
thể tích của không khí nên thể tích không khí cần là
⇒ Vkk = 5VO2 = 5.1,12 = 5,6 l
Một bình chưa 14g khí nitơ ở áp suất 1at và nhiệt độ 27°C. Sau khi hơ nóng thể tích của bình thay đổi không đáng kể và áp suất trong bình lên tới 5at. Tính thể tích của bình mà độ biến thiên nội năng của khí.
Một máy nén khí ở áp suất 1atm mỗi lần nén được 4 lít khí ở nhiệt độ 27 ° C vào trong bình chứa thể tích 2 m 3 áp suất ban đầu 1atm. Tính áp suất bên trong bình chứa sau 1000 lần nén khí. Biết nhiệt độ trong bình sau 1000 lần nén là 42 ° C
A. 2,1atm
B. 3,15atm
C. 3,05atm
D. 1,2atm
Đáp án: A
Ta có:
- Trạng thái 1: T 1 = 27 + 273 = 300 K p 1 = 1 a t m V 1 = n V = 1000.4 = 4000 l
- Trạng thái 2: T 2 = 42 + 273 = 315 K p 2 = ? V 2 = 2 m 3 = 2000 l
Áp dụng phương trình trạng thái của khí lý tưởng, ta có:
p 1 V 1 T 1 = p 2 V 2 T 2 ⇒ p 2 = p 1 V 1 T 2 T 1 V 2 = 1.4000.315 300.2000 = 2,1 a t m
Cho một khối khí xác định có áp suất 5atm , thể tích 4dm³, nhiệt độ 27°C Nén đẳng nhiệt đến khi thể tích giảm còn một phần tư .Tính áp suất của khối khí lúc này ?
Chỉ mình câu này với ạ
Ở 27 ° C thì thể tích của một lượng khí là 31. Thể tích của lượng khí đó ở nhiệt độ 127 ° C khi áp suất không đổi là?
A. 6 (ℓ)
B. 4 (ℓ)
C. 8 (ℓ)
D. 2 (ℓ)
Ở 27 ° C thì thể tích của một lượng khí là 3l . Thể tích của lượng khí đó ở nhiệt độ 127 ° C khi áp suất không đổi là ?
A. 6 ( l )
B. 4 ( l )
C. 8 ( l )
D. 2 ( l )
Đáp án B.
V 1 T 1 = V 2 T 2 ⇒ V 2 = T 2 T 1 V 1 = 273 + 127 273 + 27 .3 = = 4 l
1 chất khí lí tưởng ở trạng thái 1 có áp suất P1=2atm. Thể tích V1=30lít, nhiệt độ t1=27*C. Người ta nén đẳng nhiệt thể tích giảm xuống còn 20lít. Tính áp suất chất khí sau khi nén
Tóm tắt:P1=2atm P2=?
V1=30l V2=20l
T1=T2
Áp dụng công thức Bôi lơ Ma ri ôt ta có:
P1.V1=P2.V2⇒P2=P1.V1:V2=2.30:20=3(atm)