cho 9,6 gam kim loại Mg vào 120 gam dung dịch HCl nồng độ phần trăm của dung dịch sau phản ứng là

Những câu hỏi liên quan
Cho 9,6 gam kim loại Magie phản ứng hết với 120 gam dung dịch HCl (vừa đủ). Nồng độ phần trăm của muối thu được sau phản ứng là
A. 29,32%
B. 29,5%
C. 22,53%
D. 22,67%
Hòa tan hết 2,8 gam kim loại Fe vào cốc đựng 60 gam dung dịch HCl 7,3% thu được khí
H
2
và dung dịch X. Nồng độ phần trăm của muối sắt (II) clorua trong dung dịch sau phản ứng là A. 9,11%. B. 10,03%. C. 10,13%. D. 12,13%.
Đọc tiếp
Hòa tan hết 2,8 gam kim loại Fe vào cốc đựng 60 gam dung dịch HCl 7,3% thu được khí H 2 và dung dịch X. Nồng độ phần trăm của muối sắt (II) clorua trong dung dịch sau phản ứng là
A. 9,11%.
B. 10,03%.
C. 10,13%.
D. 12,13%.
Bài 5:Cho 4,8 gam kim loại Mg phản ứng vừa đủvới 200 gam dung dịch HCl.a. Tính thểtích khí hidro sinh ra (đktc)?b. Tính nồng độphần trăm của dung dịch axit HCl cần dùng cho phản ứng trên?c. Tính nồng độphần trăm của dung dịch muối sau phản ứng.
Đọc tiếp
Bài 5:Cho 4,8 gam kim loại Mg phản ứng vừa đủvới 200 gam dung dịch HCl.
a. Tính thểtích khí hidro sinh ra (đktc)?
b. Tính nồng độphần trăm của dung dịch axit HCl cần dùng cho phản ứng trên?
c. Tính nồng độphần trăm của dung dịch muối sau phản ứng.
a, \(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
PTHH: Mg + 2HCl → MgCl2 + H2
Mol: 0,2 0,4 0,2 0,2
\(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
b,\(C\%_{ddHCl}=\dfrac{0,4.36,5.100\%}{200}=7,3\%\)
c, mdd sau pứ = 4,8+200-0,2.2 = 204,4 (g)
\(C\%_{ddMgCl_2}=\dfrac{0,2.95.100\%}{204,4}=9,3\%\)
Đúng 2
Bình luận (0)
Cho 20, 05 gam một muối cacbonat của kim loại kiềm thổ vào 100 gam dung dịch HCl. Sau phản ứng thu được 4,4912 lít khí ở đktc. Tìm tên của kim loại trên và tính nồng độ phần trăm của dung dịch muối thu được.
\(CT:ACO_3\)
\(n_{CO_2}=\dfrac{4.4912}{22.4}=0.2005\left(mol\right)\)
\(ACO_3+2HCl\rightarrow ACl_2+CO_2+H_2O\)
\(0.2005.....0.401.....0.2005...0.2005\)
\(M_{ACO_3}=\dfrac{20.05}{0.2005}=100\left(\dfrac{g}{mol}\right)\)
\(\Rightarrow A=100-60=40\)
\(A:Ca\left(Canxi\right)\)
\(m_{CaCl_2}=0.2005\cdot111=22.2555\left(g\right)\)
\(m_{dd}=20.05+100-0.2005\cdot44=111.228\left(g\right)\)
\(C\%_{CaCl_2}=\dfrac{22.2555}{111.228}\cdot100\%=20\%\)
Đúng 1
Bình luận (0)
Câu 4. Cho 20, 05 gam một muối cacbonat của kim loại kiềm thổ vào 100 gam dung dịch HCl. Sau phản ứng thu được 4,4912 lít khí ở đktc. Tìm tên của kim loại trên và tính nồng độ phần trăm của dung dịch muối thu được.
Cho 4,8 gam kim loại M vào 50 gam dung dịch HCl nồng độ 36,5 % , phản ứng xong thu được 4,48 lít khí H2 , ( ở đktc ) và dung dịch X. Xác định kim loại M và tính nồng độ phần trăm các chất trong X.
PTHH: \(2M+2xHCl\rightarrow2MCl_x+xH_2\uparrow\) (x là hóa trị của M)
Tính theo sản phẩm
Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
\(\Rightarrow n_M=\dfrac{0,4}{x}\left(mol\right)\) \(\Rightarrow M=\dfrac{4,8}{\dfrac{0,4}{x}}=12x\)
Ta thấy với \(x=2\) thì \(M=24\) (Magie)
Mặt khác: \(n_{HCl}=\dfrac{50\cdot36,5\%}{36,5}=0,5\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{MgCl_2}=n_{H_2}=0,2\left(mol\right)\\n_{HCl\left(dư\right)}=0,1\left(mol\right)\end{matrix}\right.\)
Ta lại có: \(m_{dd\left(sau.p/ứ\right)}=m_{Mg}+m_{ddHCl}-m_{H_2}=4,8+50-0,2\cdot2=54,4\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{MgCl_2}=\dfrac{0,2\cdot95}{54,4}\cdot100\%\approx34,93\%\\C\%_{HCl\left(dư\right)}=\dfrac{0,1\cdot36,5}{54,4}\cdot100\%\approx6,71\%\end{matrix}\right.\)
Đúng 3
Bình luận (0)
Cho 5,4 gam nhôm và 175 gam dung dịch HCL 14,6% sau phản ứng chất nào còn dư dư bao nhiêu gam.b Tính nồng độ phần trăm các chất có trong dung dịch sau phản ứng 2. Hòa tan 4,2 gam mg vào 200ml dung dịch HCl a. tính thể tích h2 thoát ra điều kiện tiêu chuẩn b.tính nồng độ mol của dung dịch HCL cần dùng
1.
nAl=\(\dfrac{5,4}{27}\)=0,2 mol
mHCl=\(\dfrac{175.14,6}{100}\)=25,55g
nHCl=\(\dfrac{25,55}{36,5}\)=0,7
2Al + 6HCl → 2AlCl3 + 3H2↑
n trước pứ 0,2 0,7
n pứ 0,2 →0,6 → 0,2 → 0,3 mol
n sau pứ hết dư 0,1
Sau pứ HCl dư.
mHCl (dư)= 36,5.0,1=3,65g
mcác chất sau pư= 5,4 +175 - 0,3.2= 179,8g
mAlCl3= 133,5.0,2=26,7g
C%ddHCl (dư)= \(\dfrac{3,65.100}{179,8}=2,03%\)%
C%ddAlCl3 = \(\dfrac{26,7.100}{179,8}\)= 14,85%
2.
200ml= 0,2l
mMg= \(\dfrac{4,2}{24}=0,175mol\)
Mg + 2HCl → MgCl2 + H2↑
0,175→ 0,35 → 0,175→0,175 mol
a) VH2= 0,175.22,4=3,92l.
b)C%dHCl= \(\dfrac{0,35}{0,2}=1,75\)M
Đúng 0
Bình luận (0)
Cho 5 gam kim loại nhôm vào 150g dung dịch HCl 14,6%.
a. Hỏi nhôm có tan hết không?
b. Tính nồng độ phần trăm chất có trong dung dịch thu được sau phản ứng.
2Al+6HCl->2AlCl3+3H2
0,185-----------0,185---0,2775 mol
n Al=\(\dfrac{5}{27}\)=0,185 mol
m HCl=21,9=>n HCl=0,6 mol
=>Al td hết , HCl dư
=>C% AlCl3=\(\dfrac{0,185.133,5}{5+150-0,2775.2}\).100=15,99%
=>C% HCl dư=\(\dfrac{0,045.36,5}{5+150-0,2775.2}\).100=1%
Đúng 2
Bình luận (0)
Cho 5,4 gam kim loại M và 25,2 gam NaHCO3 vào a gam dung dịch HCl, khuấy đều cho đến khi các chất rắn tan hoàn toàn thu được dung dịch X, trong đó nồng độ phần trăm của muối clorua kim loại M, của NaCl và của HCl dư lần lượt là 13,397%; 8,806%; 1,831%, Nồng độ phần trăm của dung dịch HCl ban đầu là A. 20,00%. B. 10,00%. C. 36,50%. D. 30,00%.
Đọc tiếp
Cho 5,4 gam kim loại M và 25,2 gam NaHCO3 vào a gam dung dịch HCl, khuấy đều cho đến khi các chất rắn tan hoàn toàn thu được dung dịch X, trong đó nồng độ phần trăm của muối clorua kim loại M, của NaCl và của HCl dư lần lượt là 13,397%; 8,806%; 1,831%, Nồng độ phần trăm của dung dịch HCl ban đầu là
A. 20,00%.
B. 10,00%.
C. 36,50%.
D. 30,00%.
Đáp án A
Gọi n là hoá trị của M; x là số mol của M
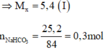
Phương trình hoá học:
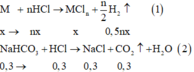
Dung dịch X thu được gồm NaCl: 0,3 mol; MCn: x mol; HCl dư

Tổ hợp (I) và (II) ta được:
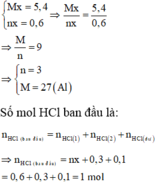
Số mol các khí thu được theo (1), (2) là:
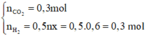
Nồng độ phần trăm của NaCl trong dung dịch X là:
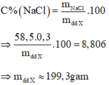
Mặt khác, ta có:
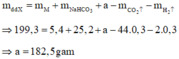
Nồng độ phần trăm dung dịch HCl ban đầu là:
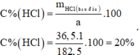
Đúng 0
Bình luận (0)



















